
Бесплатный фрагмент - Протезирующая пластика послеоперационных грыж живота
Посвящается памяти друга
Шигабудина Магдиева
От автора
За более чем вековую историю послеоперационных грыж живота изменились наши представления об этиологии и патогенезе, произошли изменения в классификации как самой нозологии, так и методов пластик дефекта брюшной стенки, появились новые методы операций. Поворотным моментом в лечении послеоперационных грыж живота стала разработка и внедрение в широкую клиническую практику технологии протезирующей пластики, основанной на применении сетчатых синтетических эндопротезов-эксплантатов и принципа пластики «без натяжения».
Революционные перемены в лечении послеоперационных грыж живота связаны с внедрением лапароскопических методов операций и разработкой современных композитных материалов для внутрибрюшинной установки. Такой эндопротез был разработан фирмой «Gore-Tex» под названием «expanded polytetrafluoroethylene» (e-PTFE). В 1993 году впервые американский хирург Karl A. LeBlanc выполнил лапароскопическую интраперитонеальную пластику с использованием этого протеза, открыв новую эру в герниологии - эру лапароскопических протезирующих операций.
Современное состояние хирургии послеоперационных грыж живота характеризуется бурным развитием и пересмотром целого ряда ранее считавшихся незыблемыми положений. Все это осложнило для практического хирурга выбор технологии лечения больных с послеоперационными грыжами живота. Многочисленные конференции, съезды, на которых рассматриваются некоторые вопросы этой сложной проблемы, призваны помочь в оказании помощи этой категории больных. На прошедшем Всероссийском пленуме хирургов (Москва, 4–7 апреля, 2017) предусматривалось принятие национальных клинических рекомендаций по послеоперационным грыжам живота, но сложность проблемы вынудила отложить принятие решения по этому вопросу еще на два года.
Эта книга, наряду с мастер-классами и специализированными конференциями, призвана помочь расширить знания практикующих хирургов по вопросам этиологии, патогенеза, современной классификации послеоперационных грыж живота, ознакомить их со ставшими «классическими» методами пластик дефектов брюшной стенки и новыми протезирующими технологиями оперирования этой сложной категории больных.
Введение
Проблема хирургического лечения послеоперационной грыжи живота существует с начала развития абдоминальной хирургии. Успехи анестезиологии и реаниматологии, совершенствование хирургической техники привели к увеличению количества и расширению объема оперативных вмешательств за счет выполнения симультанных, реконструктивных и восстановительных операций с использованием традиционного лапаротомного доступа. Среди оперируемых больных заметно выросла доля лиц пожилого и старческого возраста. При этом примерно 20—22% лапаротомий сопровождаются образованием грыжи в области послеоперационного рубца. У 80% больных послеоперационная грыжа возникает после выполнения срединного разреза длиной более 18 см, у 10% — срединной лапаротомии, у 5% — при использовании парамедианного и поперечного доступов. Существенно возрастает частота грыж после операций по поводу закрытых травм и ранений живота с применением нестандартных лапаротомных доступов. Но особенно часто послеоперационные грыжи отмечаются у больных после колопроктологических, гинекологических и неотложных абдоминальных операций (28—50%).
Свой вклад в формирование проблемной категории больных с послеоперационными грыжами живота вносят оперативные вмешательства по пересадке как отдельных органов, так и их комплексов, методики открытого ведения живота и программированных санаций брюшной полости, повторные абдоминальные операции, приводящие к образованию дефекта тканей брюшной стенки. Не стало исключением и широкое внедрение малоинвазивных вмешательств на органах брюшной полости: появилась группа больных с грыжами троакарных доступов.
Ежегодно в мире выполняется более 20 млн операций по поводу грыж брюшной стенки, что составляет 10—15% всех оперативных вмешательств. Из них 10% составляют операции по поводу послеоперационной грыжи живота. При этом лишь 1% операций выполняют в специализированных герниологических стационарах Европы и Америки, 10% — в крупных хирургических стационарах и 89% — в хирургических отделениях лечебных учреждений общего профиля. Таким образом, среди контингента больных, находящихся на лечении в общехирургических стационарах лечебных учреждений разного уровня, значимую долю составляют лица с послеоперационными грыжами живота.
Известны более 200 способов пластики дефектов брюшной стенки собственными тканями при послеоперационных грыжах живота, но ни один из них не стал «золотым стандартом» в лечении этой проблемы. Это связано как с полиморфизмом послеоперационных грыж живота, трудно поддающимся классификации, так и высокой частотой рецидивов при использовании собственных тканей. Любой вариант пластики собственными тканями приводит к избыточному их натяжению, которое тем сильнее, чем больше грыжевой дефект. В дальнейшем это приводит к дегенерации и атрофии тканей, использованных для пластики грыжевого дефекта брюшной стенки, особенно при больших и длительно существующих послеоперационных грыжах живота, и рецидиву грыжи. Частота развития рецидивов после различных операций с использованием собственных тканей может достигать 60%. В результате пожилым больным, особенно при больших и гигантских грыжах, ранее часто отказывали в хирургическом лечении.
Поворотным моментом, кардинально изменившим принципы и методы лечения больных с послеоперационной грыжей живота, стала разработка технологии протезирующей пластики, основанной на применении сетчатых эксплантатов. Прежде всего, это было обусловлено прогрессом химической промышленности в разработке и производстве современных полимеров для применения в медицине, создании на их основе новых синтетических материалов, значительно превосходящих по физико-химическим и физиологическим свойствам ранее существовавшие. В связи с широким внедрением в клиническую практику биосовместимых эндопротезов все реже и реже при лечении послеоперационных грыж живота стали применяться методы пластики собственными тканями.
Со второй половины XX века методом выбора при хирургическом лечении послеоперационных грыж живота стала протезирующая пластика сетчатым полипропиленовым эксплантатом, основным преимуществом которой является возможность пластики грыжевого дефекта без натяжения тканей («tension free»). Это привело к значительному снижению частоты рецидивов грыж, стало возможной лечение больных с большими и гигантскими грыжами в условиях общехирургического стационара и улучшило их качество жизни после операции.
Однако, несмотря на достигнутые успехи протезирующей пластики в лечении послеоперационных грыж живота, риск рецидива остается высоким. Так, по данным The Ventral Hernia Working Group (VHWG), в течение 5 лет наблюдения после операций по поводу послеоперационной грыжи живота частота повторных операций после первого рецидива составляет 24%, после второго — 35% и после третьего — 39%. Недостатки разных вариантов протезирующей пластики способствовали дальнейшей разработке технологии реконструктивной протезирующей пластики, включающей комбинирование способов закрытия дефектов брюшной стенки как с использованием собственных тканей, так и сеткой-эндопротезом. Наиболее оптимальными из оперативных вмешательств с использованием эксплантатов считают реконструктивную протезирующую пластику с позадимышечным размещением эндопротеза либо, при больших грыжах и грыжах с уменьшением объема брюшной полости (loss of domain), - реконструктивную протезирующую пластику в сочетании с операциями типа «components separation» — разделения и перемещения слоев брюшной стенки (операция Ramirez II и другие). Обязательным этапом обоих вариантов операций является транспозиция прямых мышц и восстановление белой линии живота с укреплением линии швов эндопротезом, установленным над или под апоневрозом.
С развитием видеолапароскопической техники большую популярность приобрел интраперитонеальный способ установки протеза (IntraPeritoneal Onlay Mesh — IPOM). Для проведения подобных операций необходим композитный эндопротез с противоспаечным покрытием, предотвращающий сращения к нему внутренних органов. Впервые подобную операцию успешно выполнил при послеоперационной грыже живота в 1993 году американский хирург Karl LeBlanc.
К достоинствам лапароскопического метода лечения послеоперационных грыж живота относят низкую травматичность оперативного вмешательства, минимально выраженный болевой синдром, высокую надежность (самый низкий процент рецидивирования), отсутствие раневых осложнений, раннюю реабилитацию пациента и быстрое восстановление трудоспособности. Однако лапароскопический метод лечения послеоперационных грыж живота к настоящему времени недостаточно оценен и используется лишь отдельными хирургами-энтузиастами в ряде крупных клиник.
Таким образом, лечение больных с послеоперационными грыжами живота было и продолжает оставаться актуальной проблемой как для хирургов общего профиля, так и для врачей-специалистов в области герниологии и реконструктивной абдоминальной хирургии.
Эволюция лечения послеоперационных грыж живота
Во второй половине ХIХ века, благодаря работам Луи Пастера и Джозефа Листера, было создано учение об антисептике и асептике, разработаны методы профилактики и борьбы с инфекцией, успешно начали применять эфирный наркоз с целью обезболивания во время операции. Это способствовало развитию абдоминальной хирургии, основоположником которой по праву считается великий Теодор Бильрот (рис. 1), выполнивший в 1881 году в Вене первую успешную резекцию желудка.


С началом развития хирургии органов брюшной полости встал вопрос о послеоперационных грыжах. В том же 1881 году Н. В. Склифосовский (рис. 2) на 136-м заседании хирургического общества Москвы выступил с докладом «Грыжевые выпячивания после овариотомий». Увеличение количества операций на органах брюшной полости сопровождалось пропорциональным возрастанием количества больных с послеоперационными грыжами живота. Так, по меткому выражению современника французского хирурга F. Le Torre, «…было столько же грыж, сколько оперированных больных…». Но одновременно появились работы, посвященные методам устранения послеоперационных грыж.
Первые операции по устранению послеоперационных грыж были произведены в 1882 году французским хирургом J. Lucas Championnière (рис. 3). Операция заключалась в сшивании дефекта брюшной стенки первым рядом швов с последующим его погружением вторым рядом. Благодаря своей простоте и безопасности она получила широкое распространение среди хирургов. Однако дефицит физиологически полноценных тканей вблизи грыжевого дефекта часто сопровождался рецидивом грыжи, что привело к разработке в 1886 году чешским хирургом Karel Maydl (рис. 4) апоневротической пластики со вскрытием влагалища прямых мышц живота и удвоением лоскутов апоневроза над дефектом брюшной стенки. Оба этих способа не были безупречны в предупреждении рецидива грыжи, достигавшей в ряде исследований до 68%, так как их надежность находилась в прямой зависимости от величины грыжевого дефекта, степени натяжения тканей при их сшивании и прочностных качеств апоневроза. Основным недостатком этих способов являлась большая нагрузка на верхний ряд швов апоневроза. Чем больше дефект, тем больше натяжение тканей.

Недостатки апоневротических методов пластики способствовали разработке новых мышечно-апоневротических методов. В 1898 году П. И. Дьяконов (рис. 5) для лечения послеоперационных грыж живота предложил способ создания дубликатуры брюшной стенки в поперечном к оси тела направлении, образно названный «жилет поверх штанов». В последующем этот принцип детально был разработан W.J. Мауо (рис. 6) для лечения пупочных и послеоперационных грыж, и получил известность среди хирургов как способ Мейо.

Разработка способов операций при послеоперационных грыжах в тот период базировалась на исследованиях в области хирургической анатомии передней брюшной стенки по белой линии, так как преобладающее большинство грыж возникали после срединной лапаротомии. В 1898 году К. М. Сапежко (рис. 7) впервые устранил дефект передней брюшной стенки по белой линии живота удвоением мышечно-апоневротического слоя в продольном направлении по принципу «двубортного сюртука». В последующие годы было предложено много разных модификаций этого способа. В 1920-х В. Гибсон для лечения больших дефектов брюшной стенки ввел понятие расслабляющие надрезы, что позволило ушивать брюшную стенку по белой линии с пониженным натяжением тканей. Эти идеи легли в основу многочисленных вариантов мышечно-апоневротических методов пластики послеоперационных грыж живота.

Из-за высокой частоты рецидивов при пластике грыжевого дефекта апоневротическими и мышечно-апоневротическими тканями одновременно разрабатывались и методы пластики дополнительными натуральными и искусственными материалами. Здесь уместно вспомнить слова великого Т. Бильрота (1890) в беседе со своим учеником В. Черни: «Если можно было бы искусственно создать ткань, по плотности и крепости равную фасции и сухожилию, то секрет радикального излечения грыж был бы найден!»
В 1890 году Р. Dittel предложил использовать целлоидин в виде сеток при оперативном лечении послеоперационных и вентральных грыж. Однако после небольшого опыта практического применения способ распространения не получил. Сетки вызывали мощную воспалительную реакцию и плохо вживались в ткани, крошились и отходили. Такая же участь постигла резину и пластины каучука (K. Murray, 1906).
O. Witzel в 1900 году предложил при больших дефектах брюшной стенки укреплять ее серебряной сеткой. Р. Kole (1949) применил этот метод у 862 больных при различных грыжах. Однако наблюдались случаи нагноения, фрагментации и отхождения сеток. Неэффективным оказалось использование золотых, алюминиевых и медных пластин, всевозможных сплавов (J.R. De Bord, 1908). Ввиду вредного влияния некоторых из них на ткани, частых нагноений, фрагментации, отхождения имплантатов, чрезмерной травматизации тканей от дальнейшего использования металлических и целлоидиновых сеток отказались.
В 1911 году значительным событием в области хирургии стало появление книги А. П. Крымова (рис. 8) «Учение о грыжах», в которой были подведены итоги работ отечественных и зарубежных хирургов с подробным изложением анатомических данных и способов операций при различных видах грыж брюшной стенки. Однако в целом начальный период пластической хирургии послеоперационных грыж развивался под влиянием механистических представлений об их этиологии и патогенезе. Это привело к возникновению большого количества способов операций при послеоперационных грыжах. Эти способы отличались друг от друга разной степенью сложности, а некоторые высокой травматичностью. И лишь немногие из них были патогенетически оправданны. Уже в те годы основным критерием оценки метода операции был анализ отдаленных результатов. Результаты лечения послеоперационных грыж были малоутешительны, особенно при больших грыжах.
С появлением тантала и нержавеющей стали в 20-х годах прошедшего столетия сетки из них периодически применялись при больших послеоперационных грыжах вплоть до 40—50-х годов. Затем от этого метода отказались, поскольку он вызывал дискомфорт, ригидность брюшной стенки, металл был биологически несовместим с тканями организма, окислялся, ломался, существовала опасность его миграции во внутренние органы с образованием кишечного свища (R. Stoppa, 1989).
Огромную роль в развитии пластической хирургии грыж брюшной стенки сыграли I, VI, VIII, XV и XVIII съезды российских хирургов (1901—1926). В работе этих съездов широко освещались актуальные вопросы лечения грыж белой линии живота, паховых, пупочных, бедренных, послеоперационных грыж. Решения съездов служили стимулом для дальнейших клинических и экспериментальных исследований. Особо следует остановиться на XVIII съезде российских хирургов, на котором вопрос о лечении грыж был программным. Критика методов оперативного лечения различных видов грыж брюшной стенки, анализ отдаленных результатов, изучение причин рецидивов грыж позволили внести ценные практические рекомендации. Появился принцип индивидуализации в выборе способа операции. В заключительном слове председатель съезда Г. И. Турнер (рис. 9) сказал: «Вы, может быть, надеялись получить из авторитетных уст стандартизацию вопроса, но этого быть не может… Операция грыжи должна быть субъективной и индивидуальной».

После этого съезда значительно снизился научный интерес к данной проблеме, которая на какой-то период стала считаться, в основном, решенной; вопросы лечения грыж вплоть до 60-х годов на съездах хирургов нашей страны не обсуждались. В хирургическом лечении послеоперационных грыж прочно утвердились способы Сапежко, Мейо, Напалкова (рис. 10), Вишневского (рис. 11). Однако проблема рецидивов все чаще диктовала необходимость критического пересмотра классических способов пластики и поисков новых надежных оперативных методик.
Важнейшим этапом дальнейшего развития хирургии послеоперационных грыж является экспериментальная разработка и внедрение в клиническую практику различных способов закрытия грыжевых дефектов с помощью биологических материалов. Идея трансплантатов была мощным стимулом для дальнейших научных исследований в этой, казалось бы, уже достаточно изученной области хирургии.

Но уже первые попытки пересадки биологических тканей поставили на повестку дня ряд проблем. Оказалось, что прочность тканей — важное, но отнюдь не определяющее свойство будущего трансплантата. Не менее важным является его биологическая инертность, то есть способность не вызывать в тканях грубых воспалительно-деструктивных изменений, а в организме реципиента — иммунологических реакций, быть устойчивым к инфекции, обладать свойством постепенно замещаться регенерирующими тканями реципиента. Экспериментальную и клиническую апробацию прошло множество разнообразных материалов, но лишь немногие из них заняли прочное место в лечении сложных форм грыж живота. Это, прежде всего, аутогенные трансплантаты кожи, аллогенные трансплантаты фасции, перикарда и твердой мозговой оболочки.
Развитие химической индустрии полимеров способствовало появлению новых пластических материалов для применения в хирургии, способных выдерживать любые нагрузки. Их преимущество было в эластичности, термопластичности, биологической инертности и морфологической стабильности. В зависимости от состава, это были поливинилалкоголь (гевалоновая губка), полиэтилен, полипропилен (пролен, марлекс), фторполимеры (политетрафторэтилен — ПТФЭ), полиамид (нейлон), высокомолекулярные полимеры — полиэстер (дакрон, родергон, мерсилен).
Революционные перемены в герниологии началась с применением синтетических материалов. В 1958 году американский хирург Franсis Usher (рис. 12) первым сообщил о применении полипропиленовой сетки для пластики сначала паховой, а затем и послеоперационной грыжи живота. Тогда уже он располагал сетки как над, так и под апоневрозом, с ушиванием и без ушивания грыжевого дефекта. F. Usher с сотрудниками изучал реакцию тканей на различные синтетические материалы, применяемые для пластики грыж, и доказал преимущества полипропилена, получившего широкое распространение в США.

Начало современного периода ненатяжной протезирующей пластики в 60—70 годах ХХ века связано с именами французских хирургов Jean Rives (рис. 13) и Rene Stoppa (рис. 14). В Европе в то время пользовались популярностью сетки из полиэстера — мерсилен. По методу J. Rives и R. Stoppa синтетическая сетка размещалась в пространстве между поперечной фасцией и брюшиной, охватывая всю заднюю поверхность брюшной стенки. В последующие годы были разработаны модификации способа Rives, отличающиеся разными подходами к грыжевому мешку, форме, размерам и месту установки эксплантата, методам его фиксации. При использовании всех этих модификаций были получены хорошие отдаленные результаты, низкий уровень рецидивов.

Пластические материалы позволили упростить методику операции, значительно снизить количество рецидивов, предоставили возможность достижения надежной пластики брюшной стенки при сложных формах грыж и даже в тех случаях, когда все известные методики оказывались несостоятельными.
В начале 90-х годов ХХ века при лечении больших послеоперационных грыж и послеоперационных грыж с потерей объема брюшной полости («loss of domain»), когда грыжевое содержимое при вправлении не вмещалось в брюшной полости, стали применять вместе с протезирующей пластикой операции типа разделения анатомических компонентов («components separation») брюшной стенки. Ранее таким больным хирурги отказывали в оперативном лечении. Наиболее распространенной стала операция реконструкции брюшной полости по способу перуанского пластического хирурга Oskar Ramirez (рис. 15). Суть ее заключалась в рассечении апоневроза наружной косой мышцы живота и перемещении в медиальном направлении влагалищ прямых мышц живота. Этот прием позволял при срединных грыжах закрыть дефект без натяжения до 20 см. Поверх апоневроза фиксировался либо один широкий синтетический протез, либо три меньших по размеру протеза. К настоящему времени разработано около десятка вариантов подобных операций.

Бурное развитие видеолапароскопической хирургии и использование этой новой технологии для лечения грыж живота привело к революционным переменам в современной герниологии. Мощным толчком к использованию лапароскопического метода для лечения послеоперационных грыж живота стала разработка и появление современных синтетических композитных материалов с противоспаечным покрытием для установки в брюшной полости. В 1993 году впервые в мире выполнил лапароскопическую протезирующую пластику послеоперационной грыжи живота с интраперитонеальной установкой сетки (Inta Peritoneal Onlay Mesh — IPOM) американский хирург Karl LeBlanc (рис. 16). В последующие годы были разработаны эндоскопические варианты операции разделения анатомических компонентов («components separation») передней боковой стенки живота. Лапароскопическая пластика послеоперационных грыж живота обладает всеми достоинствами малоинвазивных операций: малая травматичность, минимальный болевой синдром, отсутствие раневых осложнений, ранняя активация, раннее возвращение к обычной трудовой деятельности и высокая надежность результатов.

За 135-летнюю историю хирургии послеоперационных грыж живота методы оперативного лечения эволюционировали от простого шва дефекта в брюшной стенке до технологии протезирующей пластики грыж. Сегодня в мире ежегодно применяются несколько миллионов сеток для лечения грыж живота. Однако, несмотря на достигнутые успехи в лечении больных с послеоперационными грыжами живота с помощью различных вариантов протезирующей пластики, она пока еще далека от своего разрешения.
Хирургическая анатомия передней брюшной стенки
Передняя брюшная стенка ограничена сверху реберными дугами, снизу — паховыми складками и верхним краем симфиза. От задней брюшной стенки она отделена линиями, идущими от передних концов XII ребер вертикально вниз к гребням подвздошных костей.
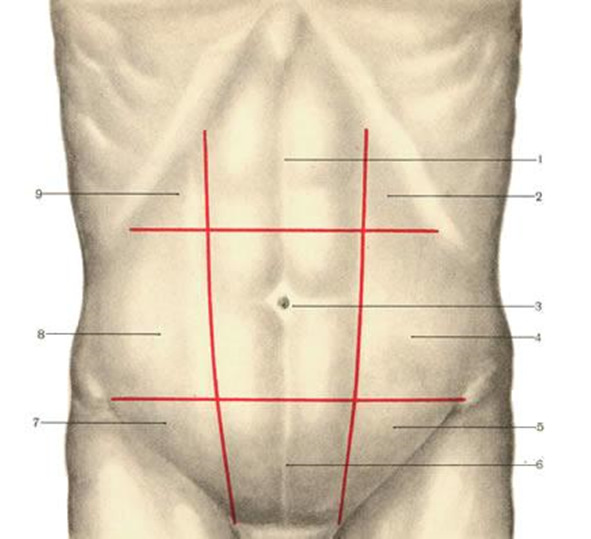
Переднюю брюшную стенку разделяют на три основные области: надчревную, чревную и подчревную. Границами между этими областями являются две горизонтальные линии, одна из которых соединяет концы X ребер, а другая — передние верхние ости подвздошных костей. Каждую из указанных основных областей подразделяют еще на три области двумя вертикальными линиями, идущими вдоль наружных краев прямых мышц живота. Таким образом, различают 9 областей: regio epigastrica (1), regio hypochondriaca dextra (9) et sinistra (2), regio umbilicalis (3), regio lateralis dextra (8) et sinistra (4), regio pubica (5), regio inguinalis dextra (7) et sinistra (5) (рис. 17).
В передней брюшной стенке различают поверхностный, средний и глубокий слои. К поверхностному слою относится кожа, подкожная клетчатка и поверхностная фасция. Средний, мышечный слой передней брюшной стенки, состоит из прямых, косых и поперечных мышц живота. Глубокий слой передней брюшной стенки состоит из поперечной фасции, предбрюшинной клетчатки и брюшины.
Кожа передней брюшной стенки тонкая, подвижная, легко берется в складку, обладает хорошей растяжимостью. В области пупка она прочно сращена с пупочным кольцом и рубцовой тканью, являющейся остатком пупочного канатика. Подкожная жировая клетчатка выражена различно; большего развития она достигает в нижних отделах брюшной стенки.
Поверхностная фасция состоит из двух листков — поверхностного и глубокого. Поверхностный листок рыхлый, расположен под поверхностным слоем клетчатки, глубокий — хорошо выражен ниже пупка и называется фасцией Томсона. Иногда фасция Томсона настолько хорошо выражена, что может быть принята хирургом за апоневроз наружной косой мышцы живота. Глубокий листок поверхностной фасции крепится к паховой связке, предупреждая распространение гнойных процессов подкожной клетчатки брюшной стенки на бедро и наоборот. Эта пластинка препятствует опусканию прямой грыжи в мошонку.
Передняя брюшная стенка имеет пять пар мышц, расположенных симметрично (рис. 18).
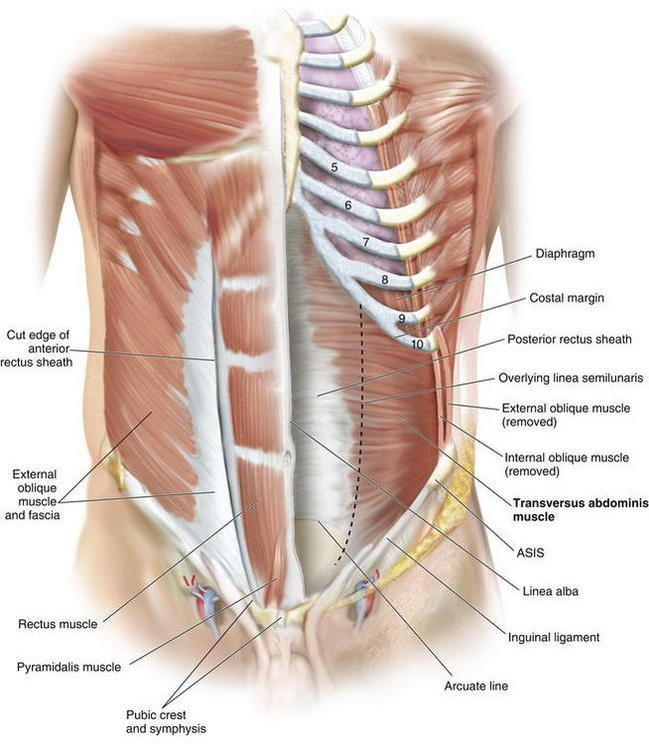
Наружная косая мышца живота берет начало зубцами от восьми нижних ребер и поясничной фасции. Ее волокна направляются вперед и вниз, переходя в широкий апоневроз. Нижняя часть апоневроза желобоватой формы, натянута между передней верхней остью подвздошной кости и лонным бугорком и называется паховой (Пупартовой) связкой. Выше паховой связки волокна апоневроза расходятся на две ножки — латеральную (крепится к лонному бугорку) и медиальную (крепится к симфизу). Ножки окаймляют наружное паховое кольцо.
Внутренняя косая мышца живота начинается от поверхностного листка пояснично-спинного апоневроза, гребня подвздошной кости и верхней половины паховой связки. Направление волокон — сзади наперед. Нижние отделы внутренней косой мышцы живота проходят вдоль семенного канатика и образуют мышцу, поднимающую яичко. Вблизи прямой мышцы волокна внутренней косой мышцы живота переходят в апоневроз.
Поперечная мышца живота берет начало задним апоневрозом от хрящей нижних ребер, пояснично-спинной фасции и от гребня подвздошной кости; вблизи наружного края прямой мышцы она переходит в передний апоневроз. Место перехода поперечной мышцы живота в передний апоневроз называется полулунной (Спигелевой) линией. Это самое слабое место передней брюшной стенки, поэтому по ее проекции возможно образование спигелевых грыж. Задняя пластинка апоневроза поперечной мышцы живота — хороший ориентир для хирурга при люмботомии, поскольку после ее рассечения обнажается забрюшинное пространство. Последняя пара межреберных нервов, проникая через задний апоневроз поперечной мышцы, образует в ней отверстие. По каналу XII пары межреберных нервов на поясницу могут проникать туберкулезные натечники и гнойные процессы из заднего средостения в виде подкожной эмфиземы поясничной области.
Прямая мышца живота начинается от мечевидного отростка и хрящей нижних ребер вблизи грудины и прикрепляется к задней поверхности лонной кости. Мышца на своем протяжении имеет 3—4 сухожильные перемычки, которые сращены с передней стенкой влагалища и не срастаются с ее задней стенкой. В связи с этим передняя клетчаточная щель между прямой мышцей живота и ее влагалищем разделена на отдельные полости, а задняя щель не разделена. Гнойники или гематомы передней клетчаточной щели строго очерчены и ограничены, легко определяются на глаз в виде выпячивания и не распространяются за пределы своих границ. При скоплении крови или гноя в задней клетчаточной щели гнойники или гематомы распространяются по всей клетчаточной щели от мечевидного отростка до лобковых костей.
Пирамидальная мышца располагается кпереди от прямой мышцы живота, имеет треугольную форму, толщиной 3—8 мм, начинается от лобковой кости и заканчивается на различных уровнях нижних отделов белой линии живота. Наиболее часто пирамидальная мышца лежит в тонком фасциальном футляре, окруженном тонким слоем рыхлой клетчатки, легко отделяется от прямой мышцы живота и перемещается кнаружи для прикрытия высокого пахового промежутка. Волокна пирамидальной мышцы разделяются прослойками соединительной ткани и несколько толще волокон прямой мышцы.
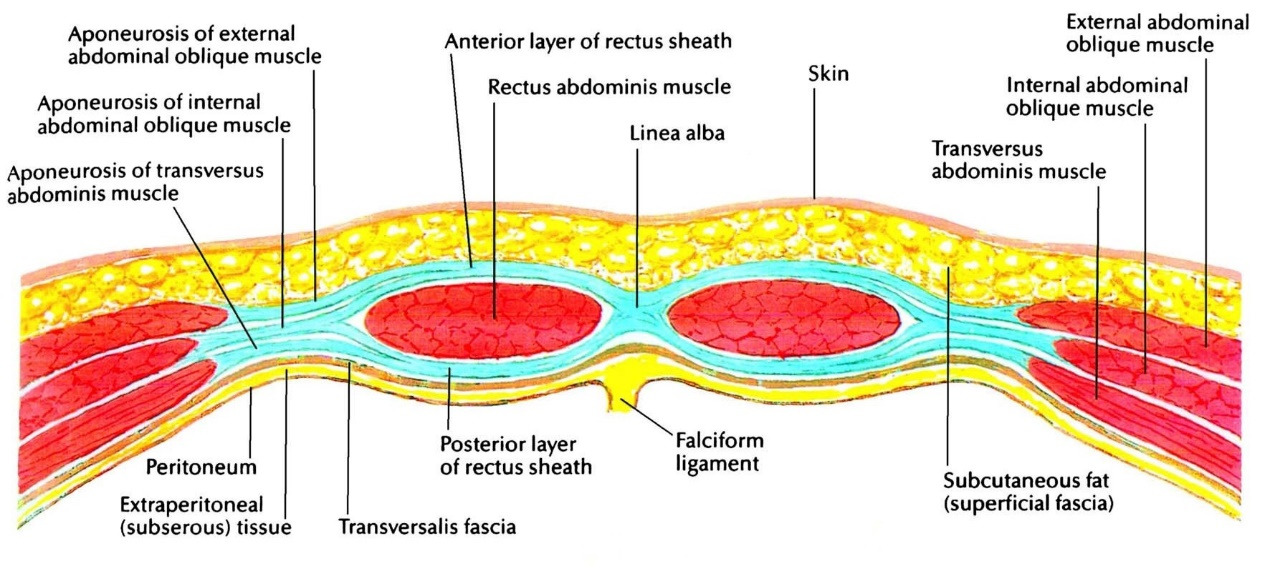
Влагалище прямой мышцы живота образовано тремя апоневротическими листками трех мышц боковой стенки живота. От мечевидного отростка до точки, расположенной на 3—4 см ниже пупка, влагалище прямой мышцы живота имеет как переднюю, так и заднюю стенку (рис. 19). Каждая из стенок состоит из полутора листков апоневрозов мышц боковой стенки живота. Передняя стенка влагалища образована апоневрозом наружной косой мышцы живота и половиной апоневроза внутренней косой мышцы живота, задняя — половиной листка апоневроза внутренней косой мышцы живота и апоневрозом поперечной мышцы живота. На 3—4 см ниже пупка все три листка апоневрозов переходят на переднюю поверхность прямой мышцы живота и образуют переднюю стенку влагалища прямой мышцы живота (рис. 20). Апоневротическая задняя стенка влагалища прямой мышцы живота ниже этого места отсутствует. Она представлена только поперечной фасцией. Место перехода всех трех листков апоневрозов на переднюю стенку влагалища прямой мышцы живота носит название дугообразной линии, или линии Дугласа.
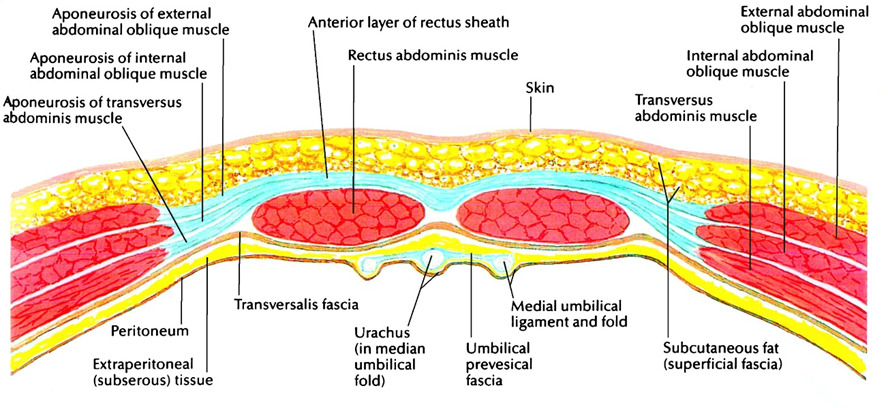
Описанная анатомия влагалища прямой мышцы живота имеет важное практическое значение в хирургии передней брюшной стенки, в частности, при пластике передней брюшной стенки по поводу послеоперационных грыж. Наличие двух апоневротических стенок влагалища прямой мышцы живота в верхних отделах дает возможность хирургу использовать передний листок полностью для пластики, вплоть до выкраивания лоскута из передней стенки влагалища на здоровой стороне и перемещения его на противоположную сторону, как это предусмотрено при пластике брюшной стенки по способу Генриха.
Отсутствие апоневротической задней стенки влагалища прямой мышцы живота ниже линии Дугласа не позволяет использовать переднюю стенку для пластических целей. Вся прочность послеоперационного рубца передней брюшной стенки ниже линии Дугласа зависит от ушитой передней стенки влагалища прямой мышцы живота. Рана ниже линии Дугласа обладает меньшей прочностью, в связи с этим здесь часто возникают послеоперационные грыжи. При ушивании передней брюшной стенки по традиционной методике в послеоперационном периоде (особенно при кашле, метеоризме) между швами передней стенки влагалища прямой мышцы живота могут попасть кусочки мышцы или предбрюшинного жира. В результате создается интерпозиция мягких тканей между швами апоневроза. В таком случае послеоперационная грыжа обеспечена, даже если рана заживает первичным натяжением. Избежать выпадения мышцы или жира между швами ниже линии Дугласа можно только при правильной технике закрытия лапаротомной раны — это использование непрерывного шва путем наложения мелких и частых стежков на края раны.
Белая линия живота образуется по средней линии в месте соединения всех трех апоневротических листков мышц боковой стенки живота. Выше пупка белая линия имеет ширину 5—10 мм, ниже пупка она суживается до 1 мм. Если выше пупка брюшную стенку можно рассечь по белой линии живота, не вскрывая переднюю стенку влагалища прямой мышцы, то ниже пупка это сделать невозможно. При нижней срединной лапаротомии всегда вскрывают переднюю стенку влагалища прямой мышцы живота справа или слева от белой линии. Белая линия в верхней части живота является «слабым местом». Между ее перекрещивающими сухожильными волокнами образуются ромбовидные щели, заполненные жировой клетчаткой, непосредственно связанной с предбрюшинной клетчаткой. Эти щели служат местом выхода сосудов и нервов, а нередко и грыжевых выпячиваний. Профилактическое использование синтетических эндопротезов для укрепления линии швов после нижней срединной лапаротомии снижает частоту формирования послеоперационных грыж живота с 35,9% до 1,5%.
Пупок с анатомической точки зрения — дефект передней брюшной стенки, а поскольку это дефект, здесь могут образовываться пупочные грыжи. Пупочное кольцо - отверстие в брюшной стенке, отграниченное со всех сторон сухожильными волокнами белой линии. Величина отверстия варьирует: может наблюдаться и почти полное отсутствие просвета, и хорошо выраженное раскрытое кольцо, в которое внедряется дивертикул брюшины. На поверхности пупочному кольцу соответствует кратерообразное втяжение кожи, которое здесь сращено с рубцовой тканью, пупочной фасцией и брюшиной. С пупком связаны два протока — мочевой (урахус), соединяющий у плода мочевой пузырь с пупком, и желточный, соединяющий у плода тонкую кишку с пупком. При заращении только пупочного кольца желточного протока образуется Меккелев дивертикул (встречается в 2% случаев).
Следующий слой передней боковой стенки живота — поперечная фасция. Она является частью внутрибрюшной фасции и имеет поперечное направление волокон. Прочность поперечной фасции в различных отделах неодинакова. В верхних отделах брюшной стенки она нежная и тонкая. По мере приближения к паховой связке, параллельно глубокой ее части, поперечная фасция становится толще и плотнее, образуя связку шириной до 0,8—1,0 см.
Париетальная брюшина отделена от поперечной фасции тонким слоем предбрюшинной клетчатки. Она выстилает стенки живота изнутри, образуя ниже пупка несколько складок и ямок (рис. 21).
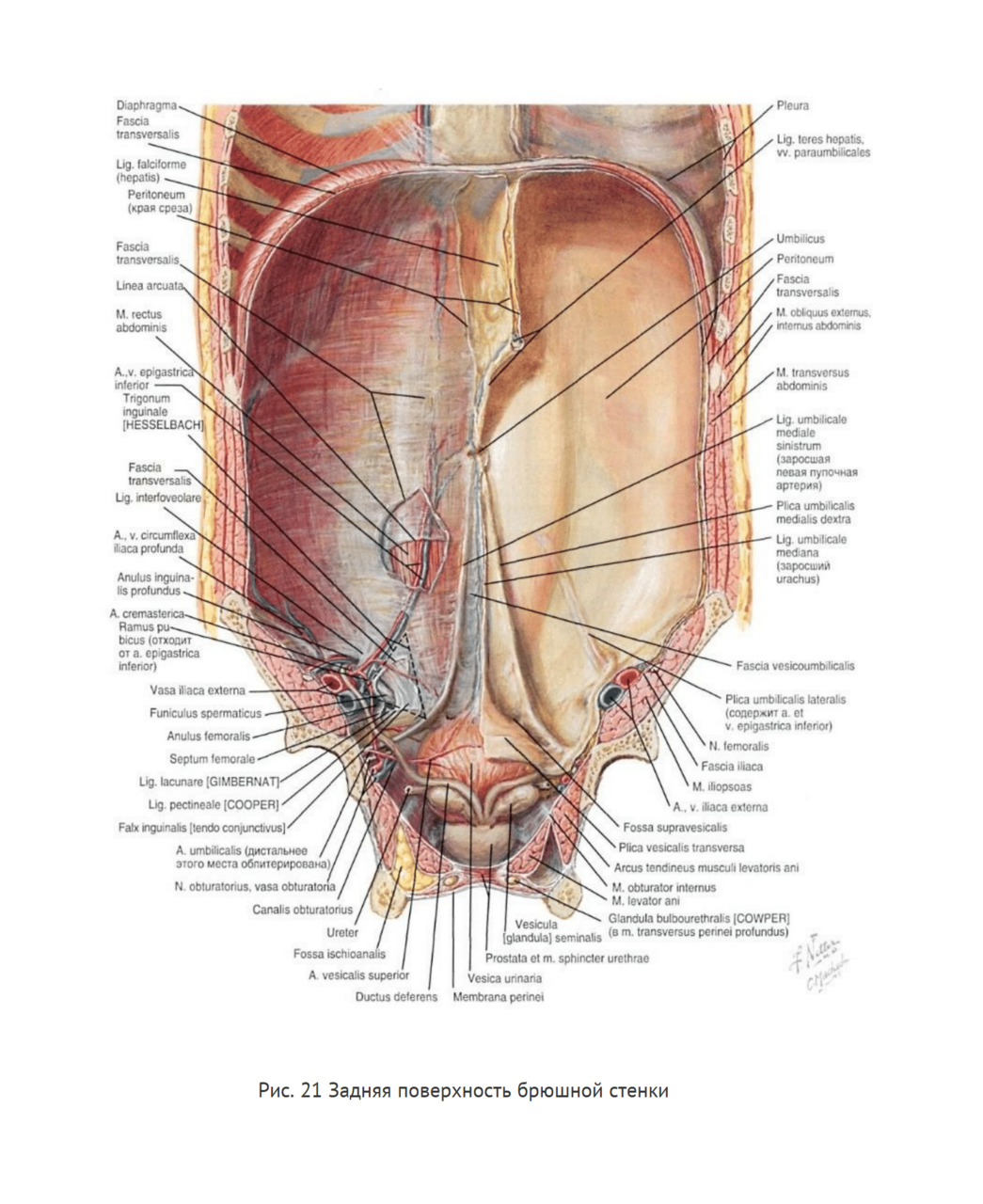
От вершины мочевого пузыря к пупку по средней линии проходит тяж — заросший урахус. Брюшина, покрывающая ее, образует срединную складку — plica umbilicalis mediana. Латеральнее от боковых отделов мочевого пузыря к пупку направляются еще два тяжа — облитерированные пупочные артерии, а покрывающая их брюшина образует медиальные пупочные складки — plica umbilicalis medialis.
Еще более кнаружи, также с обеих сторон, брюшина образует над располагающимися под ней нижними эпигастральными артериями латеральные пупочные складки — plica umbilicalis lateralis. Между складками брюшины имеются углубления или ямки: лежащая над мочевым пузырем кнаружи от plica umbilicalis mediana называется fovea supravesicalis (место выхода надпузырных грыж); расположенная кнаружи от plica umbilicalis medialis — fovea inguinalis medialis (место выхода прямых паховых грыж); лежащая кнаружи от plica umbilicalis lateralis — fovea inguinalis lateralis (место выхода косых паховых грыж).
Позадилобковое клетчаточное пространство таза (spatium retropubicum) располагается между симфизом и прикрепляющейся к его верхнему краю поперечной фасцией — спереди, и висцеральной фасцией мочевого пузыря — сзади. Это пространство делится на предпузырное (спереди) и предбрюшинное (сзади). Предпузырное пространство мочевого пузыря (называется также пространством Ретция) — пространство между предпузырной фасцией и брюшиной (рис. 22).
Предпузырное пространство (spatium prevesicale) — относительно замкнутое, треугольной или трапециевидной формы. Ограничено спереди симфизом с поперечной фасцией; сзади предпузырной фасцией, фиксирующейся с боков к облитерированным пупочным артериям или нижним надчревным сосудам; сверху — к пупочному кольцу. Нижней границей этого пространства являются средние и боковые лобково-простатические связки у мужчин, пузырно- и влагалищно-лобковые связки у женщин.
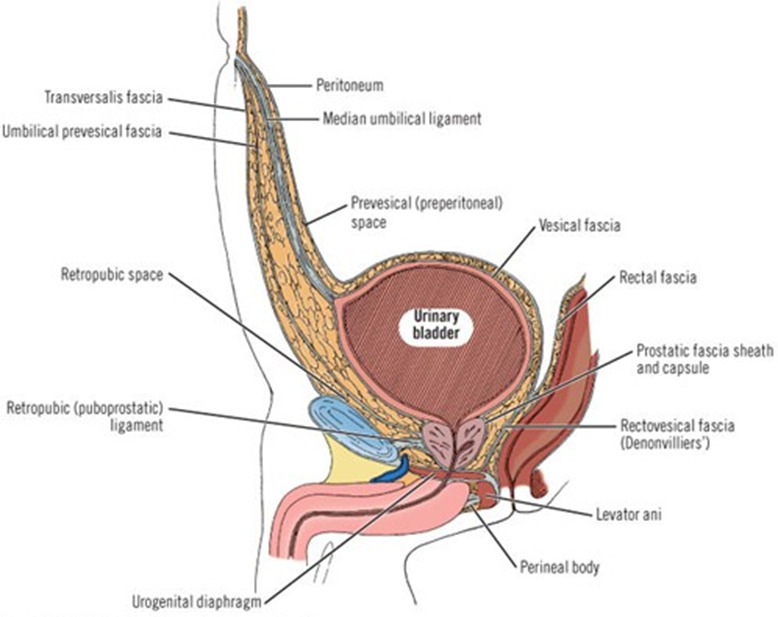
Позадилобковое простанство таза сообщается с клетчаткой передней области бедра по ходу бедренного канала; с боковым клетчаточным пространством таза — по ходу пузырных сосудов; с предбрюшинной клетчаткой через разрыв или щели в предпузырной фасции; со свободной брюшной полостью при разрыве предпузырной фасции, фасциального футляра мочевого пузыря и париетальной брюшины.
Кровоснабжение. Передняя брюшная стенка питается из пяти источников артериальных сосудов, которые создают выраженную анастомозную сеть. Артерии передней и боковых стенок разделяются на поверхностные и глубокие. Поверхностные артерии проходят в подкожной жировой клетчатке между двумя листками поверхностной фасции и отдают свои конечные ветки к коже, причем направление кожных сосудов соответствует линиям натяжения кожи.
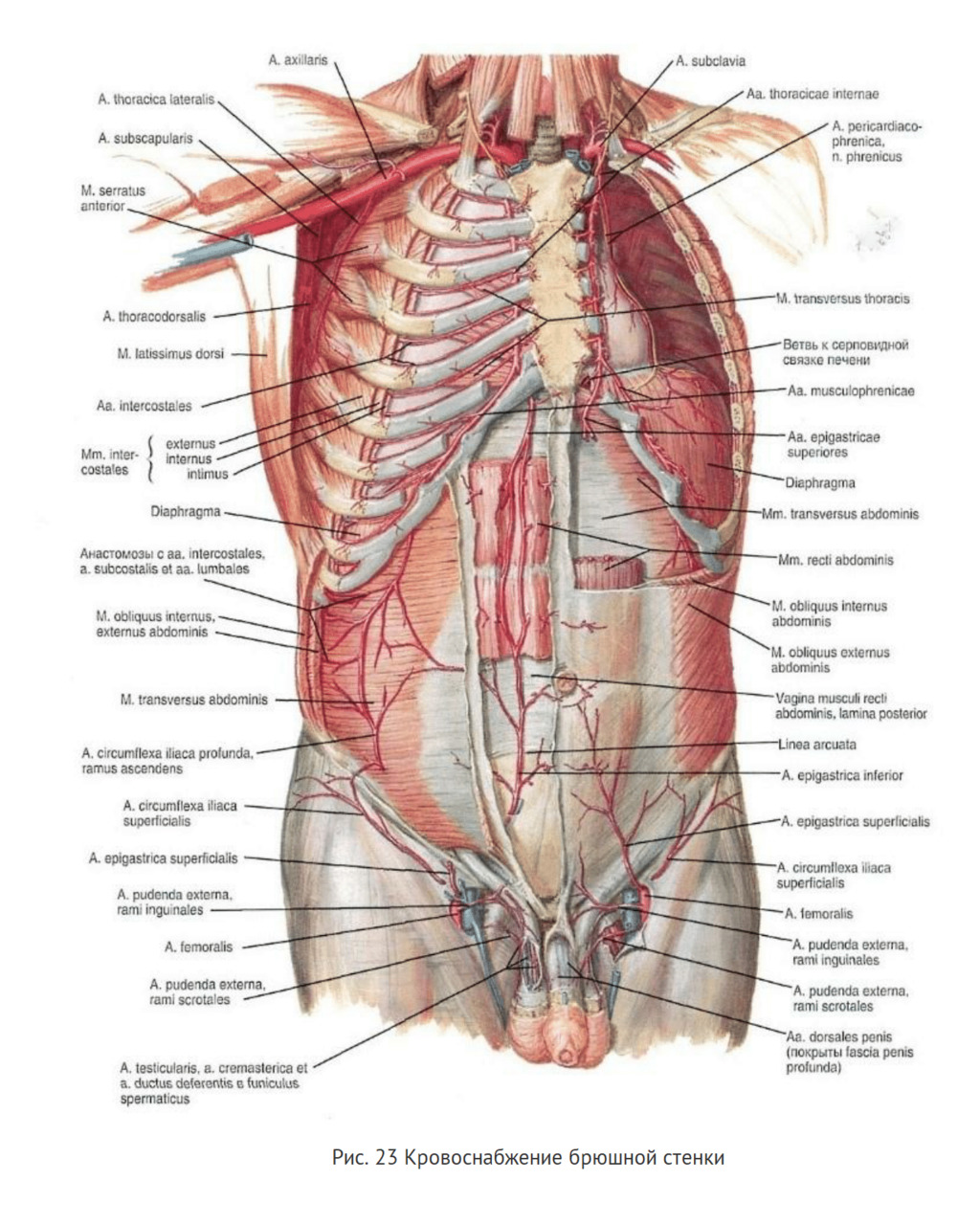
Поверхностные артерии в основном являются ветвями верхней и нижней надчревных, бедренных и межреберных артерий. Кровоснабжение кожи и подкожной клетчатки передней брюшной стенки выше пупка осуществляется кожными ветвями верхней надчревной артерии (из внутренней грудной артерии) и конечными ветвями VII — XII пар межреберных артерий. В нижних отделах кожа и подкожная клетчатка переднебоковой стенки живота снабжаются кровью из системы бедренной артерии тремя сосудами, идущими в восходящем направлении: поверхностной артерией, окружающей подвздошную кость; поверхностной надчревной артерией и наружной срамной артерией (рис. 23).
Глубокие артерии являются основным источником кровоснабжения передней брюшной стенки. Кровоснабжение мышц переднебоковой области брюшной стенки осуществляется шестью нижними межреберными и четырьмя поясничными артериями, которые проходят в сегментарном направлении между внутренней косой и поперечной мышцами живота.
Мышцы более глубоких слоев передней брюшной стенки в нижних отделах получают кровоснабжение из нижней надчревной артерии и глубокой, окружающей подвздошную кость, артерии. Обе артерии общим стволом или раздельно берут начало от наружной подвздошной артерии. Нижняя надчревная артерия кровоснабжает прямую мышцу живота, глубокая, окружающая подвздошную кость, — проходит вдоль крыла подвздошной кости и ветвится в мышцах боковой стенки живота. Отток венозной крови происходит по одноименным венам.
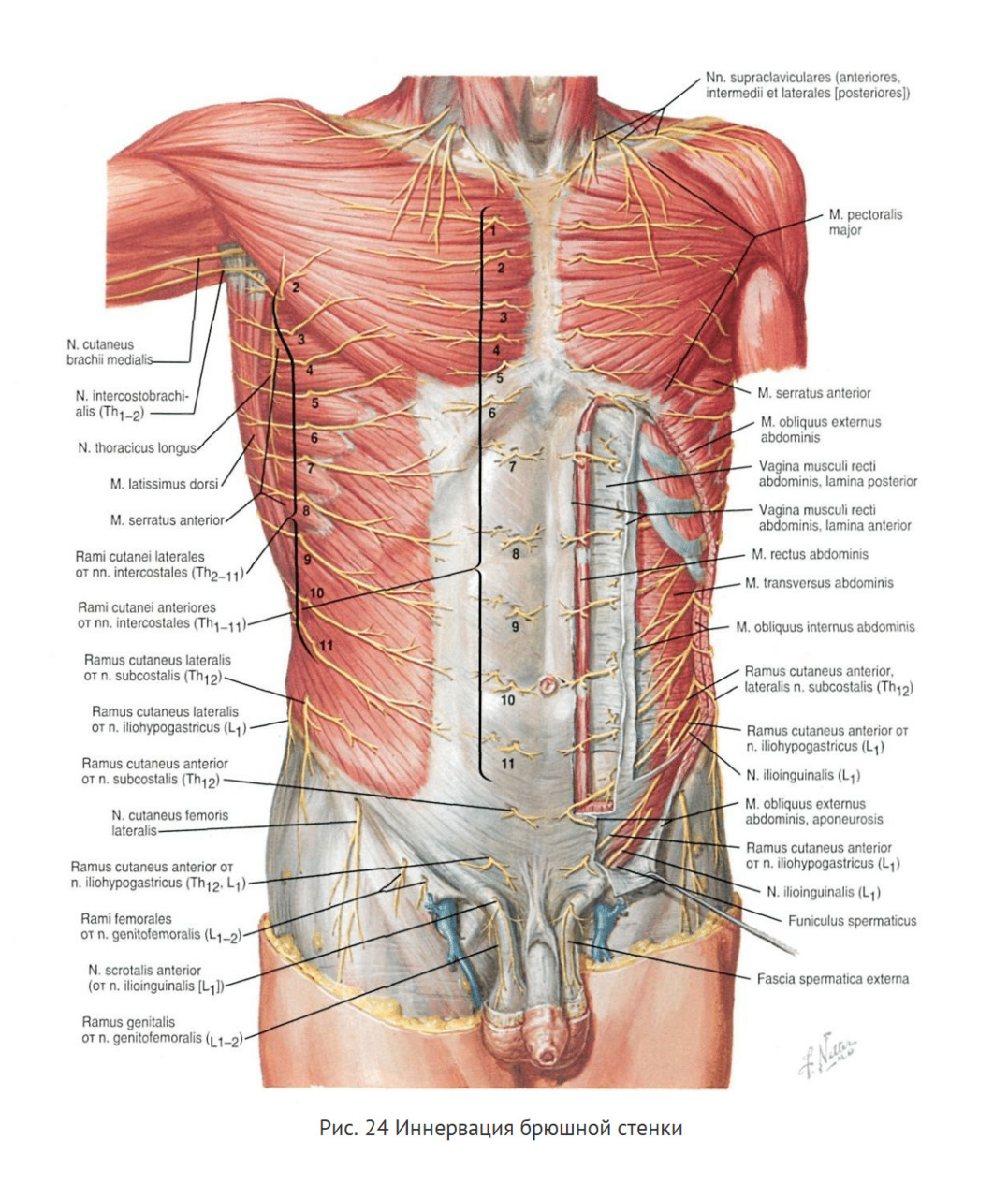
Иннервация. В иннервации передней брюшной стенки принимают участие передние ветви VII–XII межреберных и двух поясничных нервов: подвздошно-подчревного (n. iliohypogastricus) и подвздошно-пахового (n. ilioinguinalis). Верхние отделы передней брюшной стенки от мечевидного отростка до пупка иннервируются VII–X парами межреберных нервов. Последняя пара межреберных нервов обеспечивает верхнюю часть передней брюшной стенки, расположенную между пупком и лоном до дугообразной линии. Иннервация нижней части передней брюшной стенки между пупком и лоном ниже дугообразной линии осуществляется из подвздошно-подчревного и подвздошно-пахового нервов. Нижние отделы передней брюшной стенки под паховой связкой получают иннервацию из бедренно-полового нерва (n. genitofemoralis), генитальная ветвь (r. genitalis) которого расположена в паховом канале и иннервирует кожу верхних отделов наружных половых органов (рис. 24).
Основные стволы этих нервов расположены между внутренней косой и поперечной мышцами живота. Они разветвляются ко всем трем косым мышцам и делятся на поверхностные боковые кожные веточки. Каждая мышца имеет свою сегментарную иннервацию и характеризуется наличием хорошо развитых внутримышечных сплетением. Конечные ветви основных стволов проникают до влагалища прямой мышцы, проходят через ее толщу и выходят на переднюю поверхность через сухожильные перемычки и идут в направлении кожи как поверхностные передние кожные ветви. Направление основных нервных стволов — сзади вперед, сверху вниз, параллельно друг другу (рис.25).
При повреждении этих нервов происходят изменения чувствительности кожи живота, функциональных и структурных характеристик мышц (атрофия, жировое или соединительнотканное замещение). Чем ближе к периферии повреждение нерва, тем больше изменений наблюдается в зоне его иннервации.
Лимфоотток от передней брюшной стенки. Каждый слой передней брюшной стенки живота имеет свою лимфатическую систему, представленную сетью капилляров, сплетениями лимфатических сосудов, которые прерываются лимфатическими узлами и впадают в коллекторные лимфатические сосуды передней брюшной стенки. Лимфатическая сеть кожи передней брюшной стенки разделяется на поверхностную и глубокую. Поверхностная лимфатическая сеть расположена в коже передней брюшной стенки живота более поверхностно, чем сеть кровеносных капилляров, а глубокая — на одном уровне с ними. В области пупка сеть лимфатических капилляров размещена концентрическими кругами вокруг пупочного кольца. Отводящие лимфатические сосуды кожи живота находятся в подкожной жировой клетчатке, а от верхней части брюшной стенки лимфа оттекает до подмышечных лимфатических узлов (центральных и грудных) и частично — по ходу верхней надчревной артерии до грудной полости и грудных лимфатических узлов. Лимфатические сосуды с нижней части живота впадают в поверхностные паховые лимфатические узлы. Наблюдается также переход части отводящих лимфатических сосудов живота с одной стороны на другую.
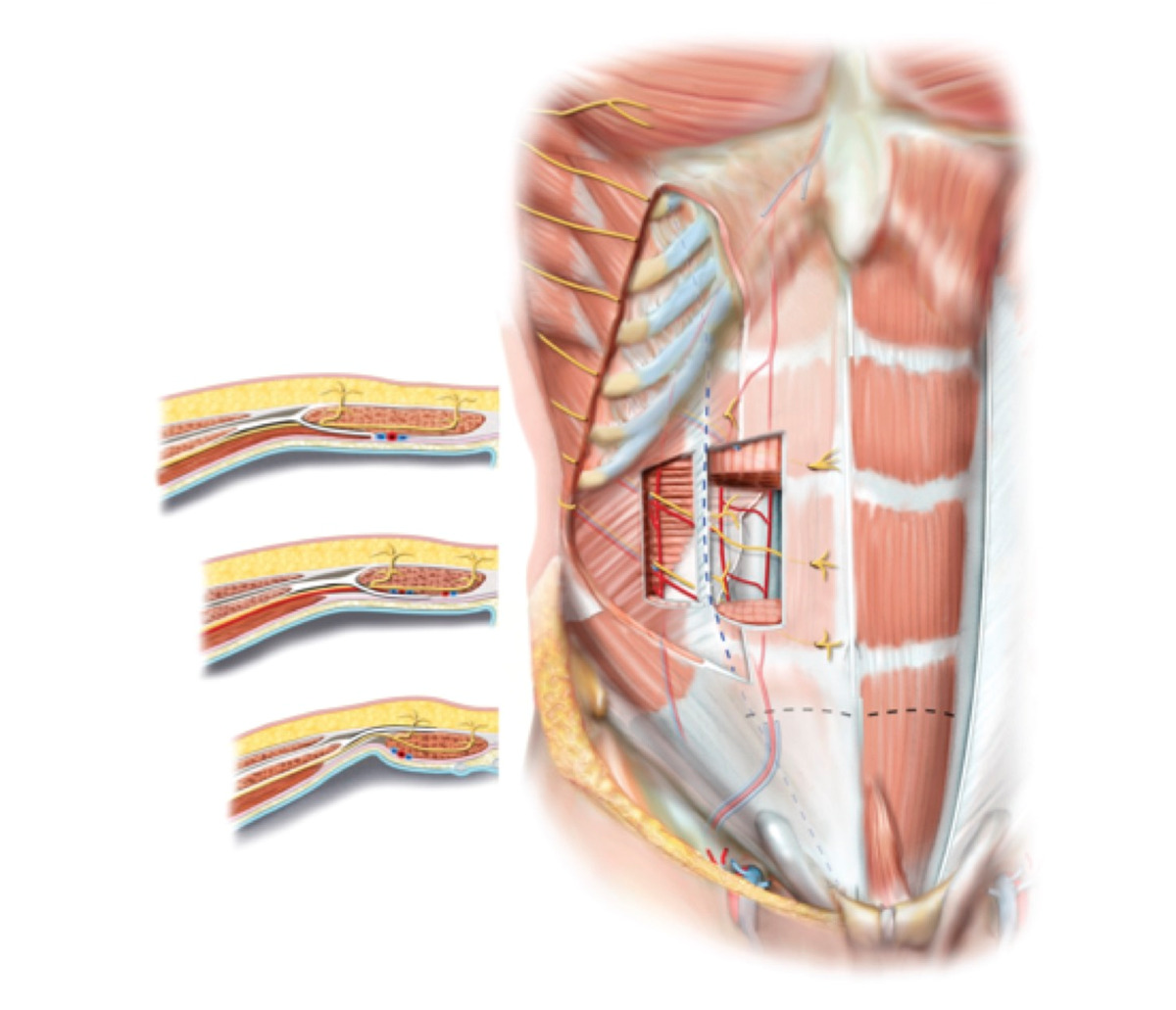
(пунктиром обозначены латеральный край влагалища прямых мышц живота и дугообразная линия)
Лимфатические капилляры апоневроза и фасций передней брюшной стенки создают одноуровневую сеть, размещенную на всем ее протяжении и проходящую между мышечными волокнами, а их отводящие сосуды расположены вдоль кровеносных сосудов. Лимфатические сосуды всех слоев передней брюшной стенки сообщаются между собой. Глубокие лимфатические сосуды, отводящие лимфу из мышц и глубоких слоев передней брюшной стенки, впадают в забрюшинные и передние медиастинальные, а со средних и нижних отделов — в поясничные и глубокие паховые лимфатические узлы. Непосредственно на передней брюшной стенке лимфатические узлы встречаются крайне редко. Особое значение при операциях по поводу послеоперационных грыж передней брюшной стенки имеет сохранение лимфооттока в нижнем отделе живота.
С точки зрения функциональной анатомии передняя брюшная стенка — часть мышечной системы, обеспечивающей движение. Она выполняет важную роль в дыхании человека, защите внутренних органов от внешних воздействий, в регуляции внутрибрюшного давления.
Мышцы переднебоковых отделов брюшной стенки образуют систему сил, взаимно уравновешивающих друг друга (рис. 26). Наружные (2) и внутренние (3) косые, поперечные (4) мышцы живота, сокращаясь в противоположных направлениях, производят растягивающее действие на белую линию живота. Прямые и пирамидальные (1) мышцы формируют систему продольно действующих мышц, которые поддерживают белую линию.
В зависимости от направления растягивающего действия боковых мышц живота на белую линию выделяют три ее участка: верхний, средний и нижний. На верхнюю треть белой линии слагаемая сил этих трех мышц действует под углом, приближающимся к прямому.
В среднем участке суммарная тяга на белую линию направлена под углом 84° с некоторыми отклонениями кверху. Поэтому на среднем участке белая линия живота испытывает наиболее выраженное растягивающее действие широких мышц. В нижнем отделе на белую линию живота широкие мышцы производят растягивающее действие под углом 120о, открытым кнаружи и кверху. Сумма сил прямых мышц в 2,5 раза слабее, чем сумма сил широких мышц. Сокращаясь, широкие мышцы растягивают белую линию латерально. Равновесие сил выравнивается благодаря тому, что фиброзные влагалища, окутывающие обе прямые мышцы, в значительной мере увеличивают возможность этих мышц противостоять в латеральном направлении.
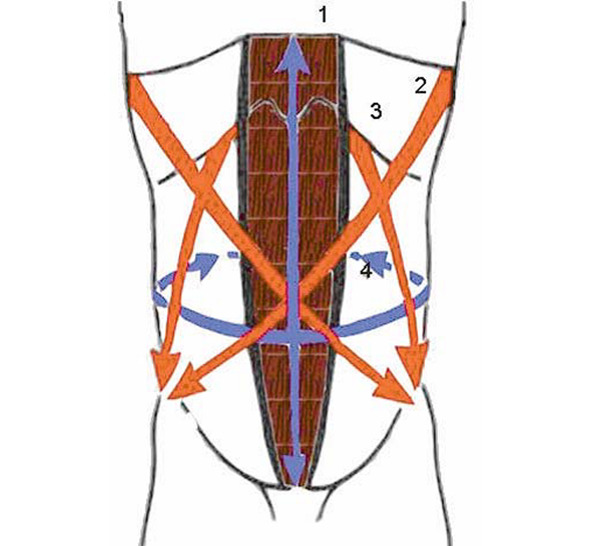
Сила прямых мышц увеличивается благодаря сухожильным перемычкам. Отдельные сегменты мышц представляют собой как бы одну самостоятельную мышцу, а перемычки являются для них точками опоры. При сохранившемся тонусе мышечно-апоневротического каркаса передней стенки живота создается определенное соотношение сил прямых и боковых мышц, препятствующих расхождению прямых мышц и образованию грыж.
Вопросы этиологии и патогенеза послеоперационных грыж живота
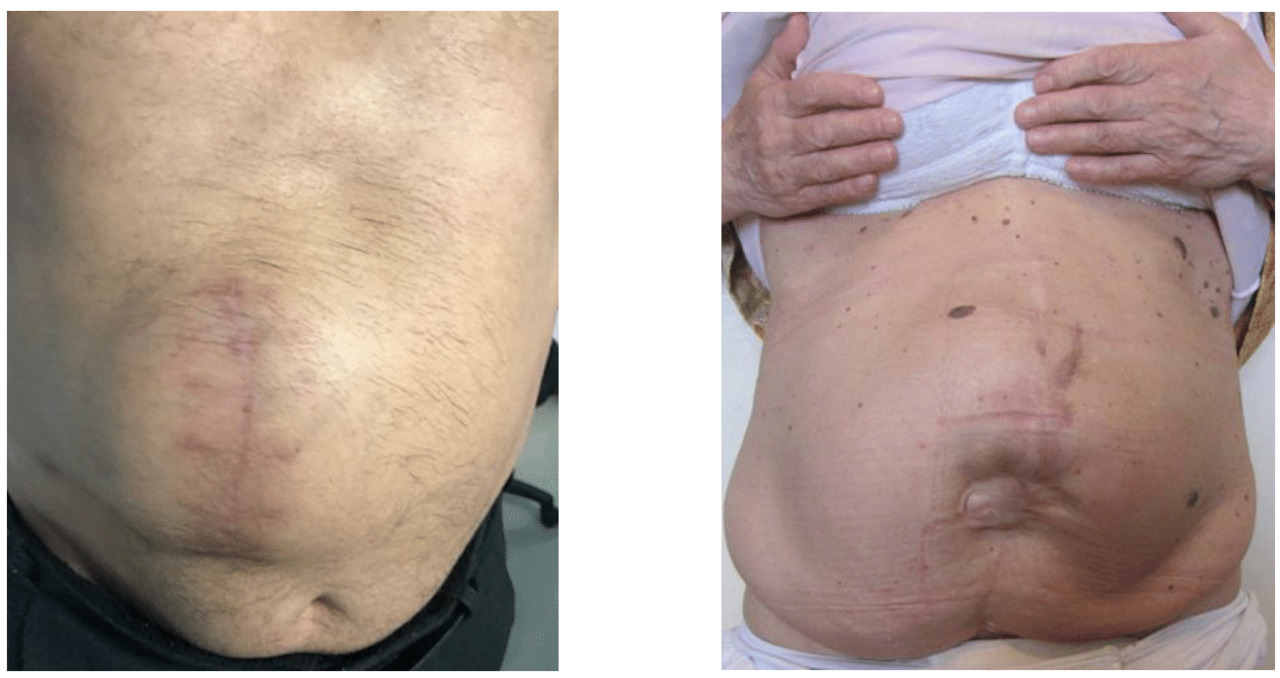
Послеоперационные грыжи живота выходят из брюшной полости через дефект в области послеоперационного рубца и располагаются под кожными покровами (рис. 27). Являясь по существу ятрогенией — следствием хирургических операций, такие грыжи в течение многих лет привлекают внимание хирургов.
Этиологические факторы послеоперационных грыж многообразны и проявляются лишь при определенных условиях. В одних случаях возникновение дефекта в мышечно-апоневротическом слое является следствием грубых дефектов в технике операции, эвентраций, ранних послеоперационных осложнений и глубоких подапоневротических нагноений. В других — нарушение функции передней брюшной стенки развивается постепенно вследствие дряблости и атрофии мышц, истончения и дегенерации апоневрозов и фасций при их денервации. И наконец, этиологические факторы третьей группы находятся в непосредственной связи с качеством регенераторных процессов в ушитой послеоперационной ране, когда образующиеся рубцы слишком податливы и непрочны, чтобы противодействовать внутрибрюшному давлению.
По современным представлениям, основой патогенеза послеоперационных грыж живота является невозможность анатомически «неустроенной» брюшной стенки адекватно противостоять резким колебаниям внутрибрюшного давления. Исследования убедительно свидетельствуют о том, что основными факторами образования грыж являются врожденная или приобретенная патология соединительной ткани в виде ее недифференцированной дисплазии, в основном за счет нарушения образования и разрушения коллагена, а также изменения его свойств.
Дисплазия соединительной ткани представляет собой уникальную онтогенетическую аномалию развития организма. Под этим термином понимают аномалию тканевой структуры, проявляющуюся в уменьшении содержания отдельных видов коллагена или нарушении их соотношения, что приводит к снижению прочности соединительной ткани многих органов и систем. Следствием этого является расстройства гомеостаза на тканевом, органном и организменном уровнях, что сопровождается различными морфофункциональными нарушениями висцеральных и локомоторных систем с прогредиентным течением. Дисплазии соединительной ткани подразделяются на дифференцированные и недифференцированные варианты.
Дифференцированные дисплазии соединительной ткани характеризуются определенным типом наследования, отчетливо очерченной клинической картиной, установленными и хорошо изученными генными или биохимическими дефектами. Наиболее частый представитель этой группы — синдром Марфана. Они редкие и диагностируются генетиками довольно быстро.
Недифференцированные дисплазии соединительной ткани диагностируются тогда, когда у пациентов набор фенотипических признаков не укладывается ни в одно из дифференцированных заболеваний. Признано, что высокими диагностическими критериями для постановки диагноза «дисплазия соединительной ткани» являются: эластоз кожи, искривления позвоночника, астеническая форма грудной клетки, плоскостопие, гипермобильность суставов, миопия, астигматизм, пролапс митрального клапана, аномально расположенная хорда, нарушения сердечного ритма, нефроптоз, пролапс гениталий, варикозная болезнь, остеохондроз позвоночника. Учитывая последние данные литературы, можно утверждать, что и грыжи живота являются одним из критериев синдрома дисплазии соединительной ткани.
Коллаген — главный белок внеклеточного матрикса соединительной ткани, определяющий ее прочность, из которого состоят фасции и апоневрозы человеческого тела. Образование коллагена и его разрушение в норме пребывают в состоянии равновесия. Тканевые аномалии онтогенеза тесно связаны как с нарушениями синтеза коллагена и фириллогенеза, так и с изменениями его биодеградации, ферментопатиями, дефектами фибронектина, эластина, гликопротеидов, протеогликанов, а также с дефицитом различных кофакторов ферментов (меди, цинка, аскорбиновой кислоты, кислорода и других), участвующих в образовании поперечных ковалентных связей, необходимых для стабилизации коллагеновых структур.
Доказано, что к образованию грыжи приводит слабость поперечной фасции живота, так как именно она является главным элементом, каркасом брюшной стенки, определяющим устойчивость к действию внутрибрюшного давления. Поперечная фасция — это соединительнотканная структура, основными компонентами которой являются коллаген и эластин. Способность соединительнотканных структур восстанавливать форму после механического воздействия связана с сетью эластических волокон, основой которых являются белки семейства эластина. Дезорганизованные эластичные волокна могут стать причиной формирования грыж.
По последним данным литературы установлено, что у больных с послеоперационными грыжами живота снижено содержание как коллагеновых, так и эластичных волокон во всех слоях передней брюшной стенки. В поперечной фасции преобладают коллагеновые волокна, а содержание эластичных волокон значительно снижено. Это говорит о том, что поперечная фасция больше подвержена растяжению. У здоровых людей без грыжи не выявлено изменений в составе соединительной ткани. Учитывая эти факты, можно предположить, что причиной грыжи являются нарушения структуры соединительной ткани.
Особо значимыми в патогенезе грыж считаются свойства коллагена (соотношение коллагена I и III типов и уровень металлопротеиназ, которые способны разрушить коллаген). Коллаген I типа является опорным субстратом, обеспечивающим зрелость и механическую прочность соединительной ткани. Незрелый коллаген III типа тоньше и не может быть достаточным для создания биомеханического барьера в брюшной стенке, что предрасполагает к формированию грыж или их рецидиву после первичной пластики. Соотношение между I и III типами коллагена определяет прочность и механическую стабильность соединительной ткани.
Ряд исследователей указывают на изменения в качественном составе коллагена. Klinge в 1999 году установил, что соотношение коллагена I и III типов в образцах кожи ниже у пациентов с грыжей по сравнению с контролем. А. Эттингер и соавторы утверждают, что это соотношение снижено и в апоневрозе наружной косой мышцы живота. Кроме того, по данным литературы, между снижением соотношения коллагена I /III в коже и апоневрозе имеется корреляционная связь. Интенсивность процессов разрушения коллагена на стороне грыжевого выпячивания выше и превалирует над его синтезом. Таким образом, локальные нарушения метаболизма коллагена, превалирование незрелого III типа коллагена над I типом сопровождаются недостаточной прочностью соединительнотканных структур брюшной стенки, которые выявлены у 80—82% грыженосителей.
Действие экзотоксинов, в том числе курение и алкоголизм, вызывают нарушение динамического равновесия в метаболизме коллагена в сторону катаболизма, что приводит к снижению прочности апоневроза и создает предпосылки для развития грыж.
Морфологическая недостаточность тканей может быть не только результатом эвентрации или обширного нагноения, но и связана с возрастом и дефектами оперативной техники. С возрастом мышцы, апоневрозы и фасции живота теряют эластичность и прочность вследствие истончения мышечных и коллагеновых волокон, появления между ними включений жировой клетчатки. Классическим проявлением морфофункциональной недостаточности тканей вследствие дефектов оперативной техники является образование послеоперационных невропатических грыж в связи с пересечением нервных стволов во время обеспечения оперативного доступа к органам брюшной полости. Наиболее часто это наблюдается после операций на печени, желчном пузыре и протоках, при поясничных доступах к почкам и мочеточникам. Денервированные участки брюшного пресса подвержены дистрофическим изменениям. Грыжевое выпячивание в этих случаях сочетается с пролабированием обширной области стенки живота за счет релаксации мышц.
Так как причиной послеоперационной грыжи, в отличие от первичной грыжи живота, является операция, то факторы, способствующие ее образованию, подразделяют на общие, характерные для всех видов грыж, и специфичные, обусловленные особенностями доступа и операции. К основным специфическим факторам, способствующим формированию послеоперационной грыжи живота, относят:
— ретракцию мышц брюшной стенки и растяжение швов после выхода больного из наркоза при прекращении действия миорелаксантов;
— протяженные разрезы при недостаточном соединении их краев и нерациональный выбор шовного материала;
— погрешности в хирургической технике при неадекватно выбранном разрезе передней брюшной стенки и дефекты при ее ушивании;
— инородные тела, дренажи и тампоны, установленные в брюшной полости;
— нагноение ран, приводящее к их заживлению вторичным натяжением с формированием истонченного рубца, не обладающего достаточной прочностью и эластичностью;
— ранняя чрезмерная нагрузка после операции.
Послеоперационные грыжи живота, возникшие в течение первого года после операции, связывают, в основном, с ранними послеоперационными осложнениями со стороны раны и органов брюшной полости. Образование грыжи через 2—3 года и более после оперативного вмешательства относят преимущественно к морфофункциональным изменениям в тканях брюшной стенки и в зоне рубца.
При длительном существовании послеоперационной грыжи живота возрастает вероятность увеличения ее размеров, чему способствуют прогрессивные нарушения иннервации и кровоснабжения тканей передней брюшной стенки вследствие гипоксии. Дистрофические процессы в мышцах нарушают не только их способность к сокращению, но и к растяжению. Ослабление мышц брюшной стенки, ее атрофия со снижением тонуса способствуют увеличению грыжевых ворот и грыжевого выпячивания.
Отдельно необходимо рассматривать группу послеоперационных грыж, содержимое которых не умещается в брюшную полость. Эти грыжи с потерей домена («loss of domain») всегда имеют большие размеры. Они образуются вследствие следующих причин: повышенный тонус брюшных мышц создает в брюшной полости давление, которое отсутствует в лишенном мускулатуры грыжевом мешке, поэтому органы брюшной полости легко перемешаются в грыжевой мешок. Длительное нахождение их вне брюшной полости приводит к сокращению мускулатуры брюшной стенки. Тонус мускулатуры приспосабливается к уменьшенному содержимому брюшной полости. Таким путем образуется уменьшенная по сравнению с первоначальным объемом брюшная полость, что отражается и на функции других внутренних органов.

Следовательно, большая послеоперационная грыжа живота — это не местный процесс, в который включены только мышцы брюшной стенки вследствие нарушения их биомеханики и трофики, а общий, при котором развиваются нарушения в сердце, легких, селезенке и диафрагме. Поэтому справедливо высказывание Ivan Goni Moreno (рис. 28): «…большую грыжу брюшной стенки надо рассматривать как самостоятельное заболевание, создающее проблемы не только со стороны органов дыхания, но и кожных покровов, мышц и внутренних органов, которые тем серьезнее, чем больше грыжа».
Классификация послеоперационных грыж живота
Классификация послеоперационных грыж живота необходима для выбора оптимального метода лечения и для анализа научных данных. Наличие большого разнообразия форм, локализации и размеров послеоперационных грыж передней брюшной стенки затрудняет создание единой общепринятой классификации. Предложенные классификации основаны на анатомо-топографической их локализации либо классифицируются по величине и форме. Для хирургов проще определять размеры послеоперационной грыжи по классификации К. Д. Тоскина и В. В. Жебровского (1980), которая позволяет дать объективную характеристику величины грыжи по топографо-анатомическим взаимоотношениям тканей в соответствующей области передней брюшной стенки. Согласно ей, различают послеоперационные грыжи:
малые — локализуются в какой-либо области передней брюшной стенки, практически не изменяют общую конфигурацию живота, многие из них определяются только пальпаторно или при УЗИ;
средние — занимают часть какой-либо области передней брюшной стенки, выпячивая ее;
обширные — полностью занимают какую-либо область передней брюшной стенки, деформируя живот;
гигантские — захватывают две, три области и более, резко деформируя живот.
Однако в этой классификации не приводятся данные о величине грыжевого дефекта, играющего ключевую роль в выборе метода лечения.
Большинство исследователей послеоперационные грыжи живота в зависимости от величины грыжевых ворот и вероятности рецидива условно разделяют на:
малые (размер грыжевого дефекта не превышает 5 см);
средние (величина грыжевого дефекта в мышечно-апоневротическом слое брюшной стенки составляет от 5 до 10 см);
большие (размеры грыжевых ворот от 10 до 20 см);
гигантские (величина грыжевого дефекта в брюшной стенке превышает 20 см).
В институте хирургии им. А. В. Вишневского, напротив, при классификации послеоперационных грыж живота не учитывают размеры дефекта, поскольку полагают, что при невправимых грыжах определить его не удается, и нередко имеется несоответствие между истинными размерами дефекта и величиной грыжевого выпячивания. Кроме того, с позиций выбора оптимального для больного метода пластики дефекта брюшной стенки значительно важнее размеры грыжевого выпячивания, подлежащего вправлению в брюшную полость, чем размеры дефекта. Поэтому размеры грыжи определяют по средней, между минимальной и максимальной, длине грыжевого выпячивания. Измерения проводят в положении больного стоя, фиксируя сантиметровую ленту между двумя противоположно расположенными точками на границе грыжевого выпячивания. В зависимости от размера выделяют четыре группы грыж:
малые — до 10 см;
средние — до 20 см;
большие — до 30 см;
гигантские — более 30 см.
На XXI Международном конгрессе герниологов в Мадриде в 1999 году наиболее обоснованной была признана классификация, предложенная J.P. Chevrel и A.M. Rath (SWR classification), в которой учтены три основных параметра: локализация грыжи, ширина грыжевых ворот, наличие рецидива.
Группа срединных грыж брюшной стенки (М) включает четыре подгруппы:
М1 — надпупочная;
М2 — околопупочная;
М3 — подпупочная;
М4 — мечевидно-лобковая.
Группа боковых грыж брюшной стенки (L) также состоит из четырех подгрупп:
L1 — подреберная;
L2 — поперечная;
L3 — подвздошная;
L4 — поясничная.
Ширину грыжевых ворот (W), измеряемую во время выполнения операции, классифицируют на четыре подгруппы (от 5 до 15 см):
W1 — менее 5 см;
W2 — от 5 до 10 см;
W3 — от 10 до 15 см;
W4 — более 15 см.
Рецидивы (R) классифицируют в соответствии с их числом:
R0 — отсутствие рецидива;
R+ — наличие рецидива, в том числе:
R1 — первый рецидив;
R2 — второй рецидив, и т. д.
Однако эта классификация не получила широкого распространения в клинической практике, так как не учитывает такие параметры, как вправимость грыжи, наличие ущемления, внешний объем грыжевого выпячивания.
В. В. Жебровский и Ф. Н. Ильченко (2003), используя современные способы визуализации тканей - УЗИ и компьютерную томографию, установили, что в области грыжевого дефекта при послеоперационных грыжах живота наиболее часто встречаются три варианта нарушения топографии брюшной стенки:
1 вариант: грыжевой дефект по средней линии живота образован медиальными краями прямых мышц, разобщенными вследствие разрушения белой линии при формировании грыжи, без нарушения целостности самих мышц;
2 вариант: топография грыжевого дефекта характеризуется не только разрушением белой линии, но и нарушением анатомической целостности и непрерывности прямых или боковых мышц брюшной стенки и их апоневротических футляров;
3 вариант: топография грыжевого дефекта имеет признаки первого и второго варианта, но отличается обширным по площади дефектом тканей брюшной стенки (15x15 см и более), неправильной формой и выраженными явлениями атрофии и истончения мышц и апоневротических структур.
Это позволило им, в зависимости от размеров грыжевого выпячивания, его локализации и особенностей нарушения топографии брюшной стенки в области грыжевого дефекта, выделить 4 классификационных типа послеоперационных грыж живота:
I тип: малые, средние, обширные и гигантские послеоперационные грыжи живота срединной локализации, для которых характерен 1-й вариант нарушения топографии брюшной стенки в области грыжевого дефекта: разрушена только белая линия живота, а анатомическая целостность мышц брюшной стенки и их апоневротических футляров сохранена;
II тип: обширные и гигантские послеоперационные грыжи живота срединной локализации, для которых характерен 2-й вариант нарушения топографии брюшной стенки в области грыжевого дефекта: разрушена не только белая линия живота, но и нарушена анатомическая целостность мышц брюшной стенки и их апоневротических футляров;
III тип: малые, средние, обширные и гигантские послеоперационные грыжи живота боковой локализации, для которых так же, как и для грыж II типа, характерен 2-й вариант нарушения топографии брюшной стенки в области грыжевого дефекта;
IV тип: обширные и гигантские послеоперационные грыжи живота всех локализаций, для которых характерен 3-й вариант нарушения топографии брюшной стенки в области грыжевого дефекта, который отличается от 1-го и 2-го вариантов обширным по площади дефектом тканей.
Одной из расширенных и клинически адаптированных модификаций SWR классификации J.P. Chevrel и A.M. Rath послеоперационных грыж живота является классификация, предложенная А. С. Ермоловым с соавторами (2005), которая рассматривает следующие позиции:
1. Локализация грыжи: срединная (верхне-, средне- и нижне-срединная),
боковая (верхняя и нижняя),
сочетанная (срединная с боковой).
2. Величина грыжи по диаметру грыжевого выпячивания или относительному объему грыжи в процентах по данным компьютерной томографии:
малая (менее 5 см или менее 5%),
средняя (5,1—15,0 см или 5,1—14,0%),
большая (15,1—30,0 см или 14,1—18,0%),
гигантская (более 30 см или более 18,0%).
3. Ширина грыжевых ворот:
малая (менее 5 см);
средняя (5,1—10,0 см);
большая (10,1—15,0 см);
гигантская (более 15,0 см).
4. Вправимость грыжи: вправимая и невправимая.
5. Рецидив грыжи и кратность возникновения.
6. Ущемление грыжи: ущемленная и неущемленная.
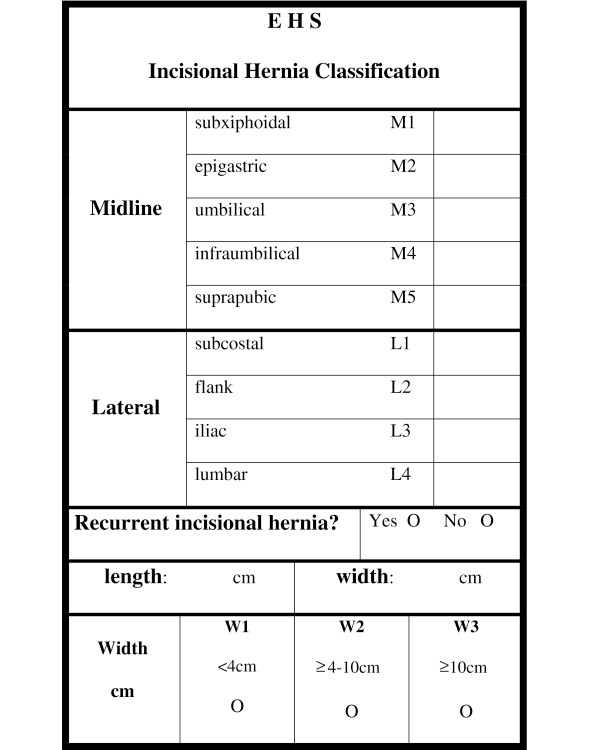
Современная классификации Европейского общества герниологов (EHS), принятая консенсусом на международной конференции герниологов в Генте, Бельгия, 2—4 октября 2008 года, различает следующие виды послеоперационных грыж передней брюшной стенки.
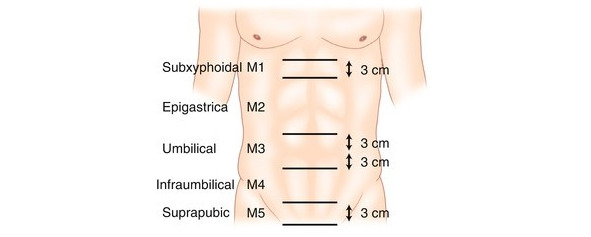
Медиальная грыжа или грыжа средней линии (обозначается буквой М).
Границы средней линии области определяются следующим образом:
1. краниально: мечевидный отросток;
2. каудально: лобковая кость;
3. сбоку: латеральные края прямой мышцы живота.
Обозначают:
M1: субксифоидальная грыжа (от мечевидного до 3 см каудально);
M2: эпигастральная (от 3 см ниже мечевидного до 3 см выше пупка);
M3: пупочная (от 3 см выше до 3 см ниже пупка);
M4: инфраумбиликальная (от 3 см ниже пупка до 3 см над лобком);
M5: надлобковая (от лобковой кости до 3 см краниально) (рис. 29).
Различные дефекты в передней брюшной стенке, вызванные одним разрезом, рассматриваются как одна грыжа. Если различные дефекты были вызваны двумя и более различными операционными разрезами, то они должны быть рассмотрены как два и более грыжи.
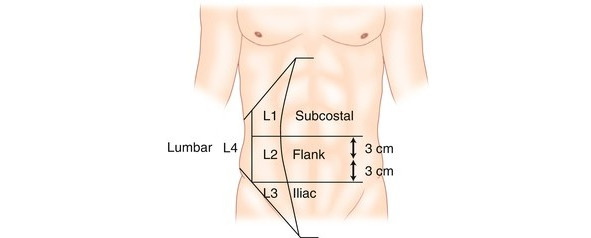
Боковые грыжи (обозначается буквой L).
Границы площади боковой поверхности определяются как:
1. краниально: края реберных дуг;
2. каудально: пахововые области;
3. медиально: латеральные края прямой мышцы живота;
4. сбоку: поясничная область.
Обозначают:
L1: подреберье (от переднего края и горизонтальной линии на 3 см выше пупка);
L2: фланк (сбоку от прямой мышцы на 3 см выше и ниже пупка);
L3: подвздошная область (между горизонтальной линией на 3 см ниже пупка и паховой областью);
L4: поясничная (латеро-дорзальная часть от передней подмышечной линии) (рис. 30).
Определение размера грыжи
Ширина грыжевого дефекта определяется как наибольшее горизонтальное расстояние в см между боковыми краями дефекта грыжи с обеих сторон. В случае нескольких дефектов ширина грыжи измеряется между наиболее поперечно расположенными краями наиболее латерально расположенных дефектов на той же стороне. Длина грыжевого дефекта определяется как наибольшее расстояние по вертикали в см между наиболее краниальной и наиболее каудальной краями грыжевого дефекта. В случае нескольких дефектов грыжи от одного разреза длина определяется между наиболее краниально расположенным дефектом и наиболее каудально расположенным дефектом (рис. 31а, б).
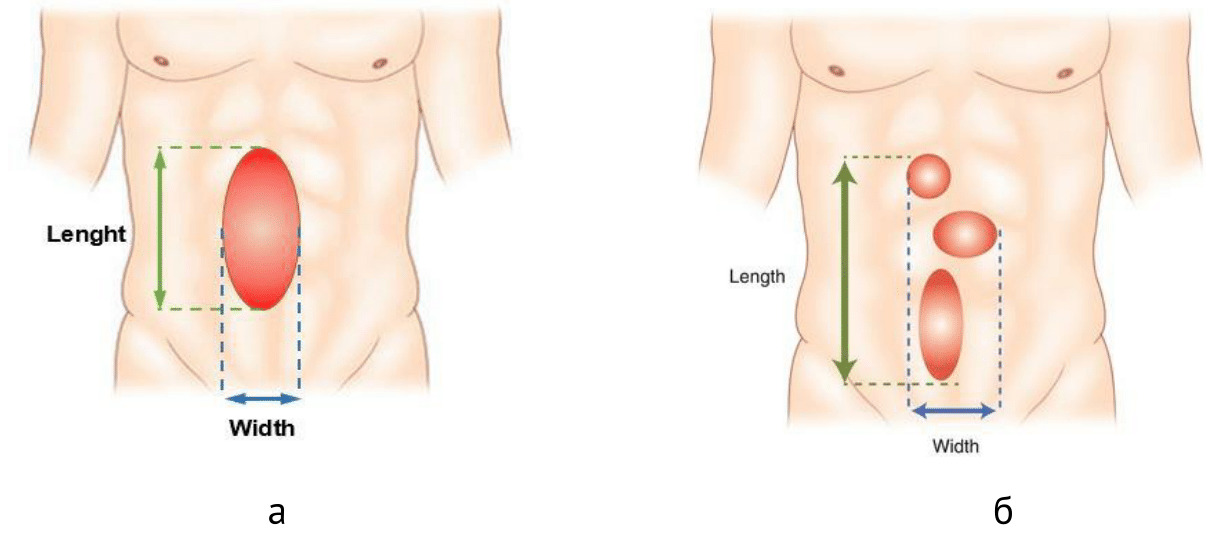
Грыжевая поверхность дефекта может быть измерена путем объединения ширины и длины в форме овала.
По максимальной ширине грыжевого дефекта послеоперационные грыжи описывают как:
W1 <4 см;
W2 ≥ 4—10 см;
W3 ≥ 10 см.
По вправимости грыжи различают:
1. Вправимые (редуцируемые) с или без обструкции;
2. Невправимые (нередуцируемые) с или без обструкции.
По наличию симптоматики:
1. Бессимптомная;
2. Симптоматическая.
После проведения соответствующих исследований и специальных измерений полученные результаты заносят в таблицу «Основные классификационные признаки послеоперационных грыж живота EHS».
Использование практикующими хирургами классификации Европейского общества герниологов (EHS) позволит в ходе клинических исследований сравнивать различные варианты лечения послеоперационных грыж живота как у нас в стране, так и за рубежом, чтобы унифицировать подходы к ведению и улучшить результаты лечения у данной категории больных.
Таблица
Основные классификационные признаки
послеоперационных грыж живота EHS
Клиника и диагностика послеоперационных грыж живота
Клиническая картина послеоперационных грыж живота весьма разнообразна и характеризуется наличием в области послеоперационного рубца или в стороне от него выпячивания, исходящего из брюшной полости, теоретически любой формы и размеров. В большинстве случаев оно безболезненно, но у части больных отмечаются болевые ощущения в области выпячивания при физическом напряжении, кашле. В грыжевом мешке может находиться любой орган брюшной полости в зависимости от локализации дефекта на послеоперационном рубце. Сращение этих органов с внутренней поверхностью грыжевого мешка или к грыжевым воротам вызывает болевые ощущения при физическом напряжении. Более того, фиксация в грыжевом мешке кишечных петель может способствовать возникновению симптомов, характерных для хронической кишечной непроходимости.
У части больных кроме болей могут иметь место жалобы на тошноту, отрыжку, изжогу, чувство давления в различных отделах живота, запоры. Все эти жалобы могут быть проявлениями как послеоперационной грыжи живота, так и сопутствующих заболеваний органов пищеварения.
Следует помнить, что боли в области грыжевого выпячивания чаще возникают при напряжении мускулатуры передней брюшной стенки, связанной либо с физической нагрузкой, либо с длительным неудобным положением тела. В покое, в горизонтальном положении тела боли исчезают, а грыжа полностью или частично вправляется в брюшную полость. Нередко больные сами вправляют грыжу руками и применяют различные приспособления для предотвращения выхождения внутренностей в грыжу.
В анамнезе у больных с послеоперационными грыжами живота отмечают одну и более операций на органах брюшной полости, при этом необходимо обратить внимание при опросе на особенности заживления операционной раны и сроки появления выпячивания в области послеоперационного рубца. Также важно выявление у больного общих факторов риска, способствующих образованию грыжи: морбидное ожирение — индекс массы тела больше 35 кг/м2 (ИМТ≥35кг/м2), курение, сахарный диабет, иммуносуппрессия, хронические заболевания легких, сердечные заболевания.
При осмотре живота обращают внимание на форму, размеры и количество послеоперационных рубцов на коже брюшной стенки. Кожа в области послеоперационного рубца над выпячиванием может быть не изменена или пигментирована, изъязвлена вплоть до развития хронического дерматита. Через истонченный послеоперационный рубец может быть видна перистальтика припаянных петель кишечника. При значительном расхождении краев апоневроза или мышц живота наблюдаются функциональные изменения всей брюшной стенки с ослаблением брюшного пресса, атрофическими изменениями в мышцах, истончением апоневроза.
Форма грыжевого выпячивания теоретически может быть любой, но чаще круглая или овальная, она может занимать часть или весь послеоперационный рубец, находится под рубцом или рядом на некотором расстоянии от него. Выпячивание в стороне от рубца возникает на месте разрыва апоневроза по точкам проведения швов, завязанных с натяжением или прорезавшихся в послеоперационном периоде. Довольно часто послеоперационные грыжи живота бывают множественными по типу «швейцарского сыра». В горизонтальном положении вправимые грыжи исчезают сразу, не оставляя заметной припухлости, при больших грыжах после вправления остается некоторое выпячивание.
При невправимых и не вмещающихся в брюшной полости грыжах с потерей домена (loss of domain) выпячивание не исчезает в положении лежа. Содержимым грыжи может быть не только сальник и петли тонкой кишки, но и желчный пузырь, печень, различные отделы толстой кишки, желудок и даже мочевой пузырь.
Обычно диагностика послеоперационных грыж не представляет трудностей. Хирург при осмотре больного обращает внимание на асимметрию живота за счет выпячивания области послеоперационного рубца. При грыжах малых размеров это выпячивание определяют пальпаторно. Определение истинных размеров грыжи, величины и формы грыжевых ворот производят в положении лежа на спине. Врач, пальпируя живот, предлагает больному опереться на локти, приподнять голову и верхнюю часть туловища. При этом мышцы брюшного пресса напрягаются, а грыжевое выпячивание рельефно выделяется на поверхности брюшной стенки. Этот прием позволяет определить не только размеры грыжи, но и наличие добавочных грыжевых выпячиваний в стороне от основного.
У тучных людей, особенно с морбидным ожирением, при малых размерах послеоперационной грыжи приходится производить повторные исследования, чтобы обнаружить дефект в области послеоперационного рубца. Для определения грыжи больному предлагают покашлять или натужиться. Важно установить распространение грыжи по передней брюшной стенке.
Предварительно о содержимом грыжевого выпячивания судят по результатам перкуссии: тупым перкуторным звуком сопровождается наличие в грыжевом мешке сальника, притупленным — наличие сальника и кишки. Пальпацией определяется консистенция грыжевого выпячивания. При наличии в грыжевом выпячивании кишечной петли консистенция его мягкоэластичная, сальника — мягкая, мелкодольчатая. Важные дополнительные сведения дают ультразвуковое и рентгенологическое исследования.
Алгоритм ультразвукового обследования больных с послеоперационной грыжей живота до операции включает:
— исследование периферических участков брюшной стенки и участков брюшной стенки, вовлеченных в патологический процесс (послеоперационного рубца; грыжевого выпячивания; определение размеров грыжевых ворот; осмотр содержимого грыжевого мешка, а при обнаружении в грыжевом мешке петель кишечника необходимо уточнить жизнеспособность кишки по перистальтическим движениям и с помощью цветного дуплексного картирования кровотока);
— при ранее выполненных протезирующих пластиках визуализация прежнего имплантата;
— определение ширины и толщины прямых мышц живота;
— осмотр органов брюшной полости, забрюшинного пространства и органов малого таза (печени и внепеченочных желчных протоков, поджелудочной железы, кишечника, почек и мочевого пузыря, матки с придатками у женщин, предстательной железы и органов мошонки у мужчин);
— дуплексное сканирование вен нижних конечностей и нижней полой вены с оценкой динамики венозного кровотока.
Полученные данные при ультразвуковом исследовании передней брюшной стенки и органов брюшной полости позволяют: оценить состояние мышечно-апоневротических структур; определить ширину основного грыжевого дефекта (рис. 32), наличие или отсутствие дополнительных грыжевых отверстий; выявить симультанную хирургическую патологию органов брюшной полости; определить характер спаечного процесса и выраженность явлений частичной кишечной непроходимости; выявить очаги хронического воспаления. Однако при больших грыжах информативность УЗИ значительно снижается, в связи с чем для получения более точной информации по всем параметрам грыж необходимо проведение рентгеновской компьютерной томографии.
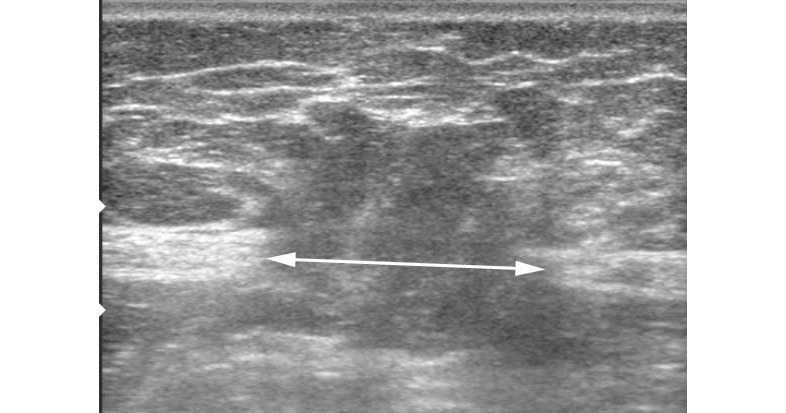
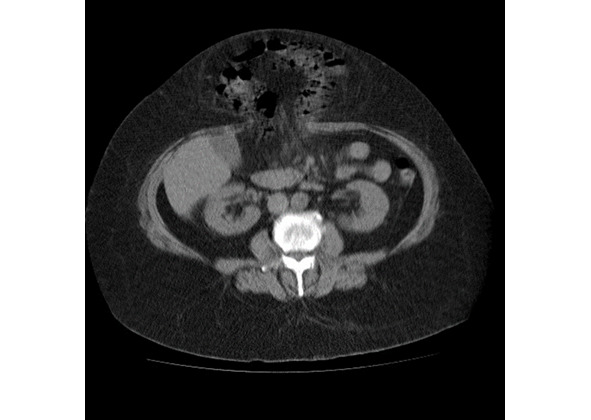
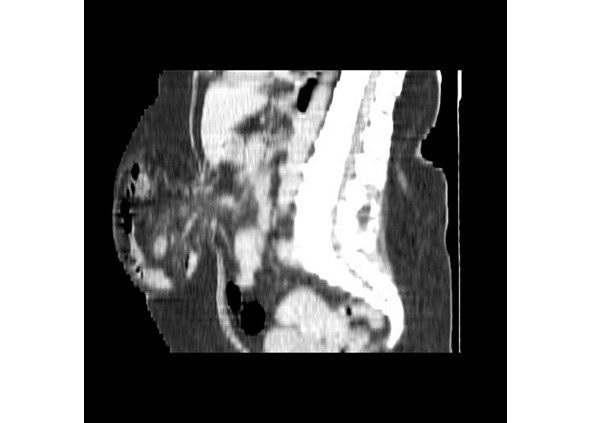
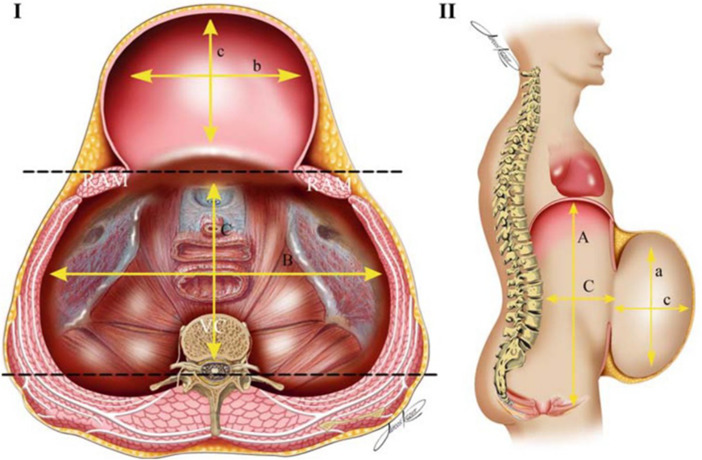
Рентгеновская компьютерная томография позволяет изучить состояние брюшной стенки, грыжевого выпячивания, его содержимого (рис. 33 а, б). Возможна качественная и количественная оценка параметров мышечно-апоневротических структур в виде измерения толщины мышц, оценки плотности (повышения или понижения) мышечной ткани. Для объективного измерения объемов брюшной полости и грыжевого выпячивания с помощью рентгеновской компьютерной томографии применяется методика герниоабдоминометрии. Расчеты объемов брюшной полости и грыжевого выпячивания производятся измерительной программой компьютера по методу расчета объема эллипса путем измерения трех параметров (рис. 34). Сравнивая два объема, рассчитывается относительный объем — отношение объема грыжи к объему брюшной полости. Полученное соотношение обозначается как «относительный объем грыжи», этот показатель выражается в процентах (рис. 35).
С помощью рентгенологического метода также можно определить, какие органы являются содержимым грыжевого мешка, и каково их функциональное состояние. Прежде всего это относится к тонкой кишке. Исследование пассажа бариевой взвеси позволяет установить степень ее вовлеченности в спаечный процесс, нарушения двигательной функции, признаки кишечной непроходимости (рис. 36). Эти сведения, безусловно, во многом могут определить показания к выполнению и стратегию оперативного вмешательства.
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.