
Бесплатный фрагмент - Персонализированная медицина нового поколения: клональная реконституция гемопоэза и CHIP-основанная
Об авторе

Андрей Степанович Брюховецкий — профессор, доктор медицинских наук, ветеран Министерства обороны РФ, полковник медицинской службы в запасе. В настоящее время является генеральным директором АО «Клинический госпиталь „НейроВита“», врач-невролог высшей категории, вице-президент Международной ассоциации нейровосстановления (International Association of Neurorestoratology), член редколлегии ряда научных журналов: «Гены и клетки», Journal of Translational Neuroscience and Clinics, Journal of Neurorestoratology, Journal Oncology Letter. С 1989 года в рамках программ Министерства обороны РФ занимался применением двойных критических технологий в медицине. С 1996 по 2002 год руководил лабораторией высоких технологий ГУ НИИ трансплантологии и искусственных органов Минздрава РФ. С 2003 по 2013 год был координатором научной отраслевой программы РАМН «Новые клеточные технологии — медицине». С 2002 по 2006 год возглавлял кафедру клеточной восстановительной медицины ГОУ ВПО «Российский государственный медицинский университет» им. Н. И. Пирогова. С 2012 по 2015 год — руководитель Центра биомедицинских технологий ФГБУ «Федеральный научно-клинический центр» ФМБА России. С 2016 по 2019 год — ведущий научный сотрудник Научно-исследовательского отдела Центральной клинической больницы Российской академии наук (РАН). Автор 247 научных публикаций в рецензируемых национальных и международных специализированных научных журналах, 17 научных монографий в области регенеративной медицины, неврологии, онкологии и 15 глав в коллективных монографиях на русском и английском языках, а также автор 22 патентов РФ, 6 международных заявок PCT и патента США.
Список условных сокращений и обозначений



Предисловие
Персонализированная медицина (ПМ) в последние годы стала ведущим трендом всего мирового здравоохранения. Широкое внедрение ПМ в систему охраны общественного здоровья человеческой цивилизации определяет ее как новую высокотехнологичную ступень медицины следующего поколения или первую технологическую генерацию медицины будущего. Ее появление связано с бурным развитием в начале XXI века высокоточных областей биомедицинской науки (геномики, транскриптомики, РН-номики, протеомики, метаболомики и др.) и активным внедрением этих высокоточных, прецизионных, так называемых ОМИК-технологий в практическую медицину. Благодаря этому современная медицина стремительно изменяется и становится пациентоориентированной и индивидуализированной. Однако есть обратная сторона персонализации и стремительного внедрения научно-технологического прогресса в современную медицину. Эта медицина становится крайне сложной, высокотехнологичной, наукоемкой, очень дорогостоящей и практически недоступной большому количеству больных людей в мире.
Еще одна насущная потребность в появлении ПМ заключается в отсутствии в текущем моменте реального клинического прогресса в лечении большинства смертельных болезней цивилизации (БЦ) современными методами конвенционального здравоохранения. Год от года количество фатальных и неизлечимых БЦ в мире стремительно растет, и прогнозы увеличения их количества к 2050 году выглядят просто катастрофическими и угрожающими для выживания человеческой популяции. Так, количество онкологических пациентов в мире увеличится с 11 млн случаев в 2023 году до 40 млн пациентов к 2050 году (Каприн А. В., 2023). Количество пациентов с нейродегенеративными болезнями (НДБ) также стремительно увеличивается, и к 2030 году их количество в мире достигнет 40 млн человек. По данным Всемирной организации здравоохранения (ВОЗ). количество больных с НДБ к 2050 году достигнет 130 млн человек. И такая же угрожающая ситуация по выживанию человека и всего человечества подтверждается медицинской статистикой, представленной ВОЗ в 2023 году для большинства аутоиммунных, сердечно-сосудистых и наследственных БЦ. Возможно, что значительную роль в этом негативном социально-экономическом тренде сыграла мировая пандемия коронавируса (КОВИД-19), которая почти в 2—3 раза увеличила количество некурабельных пациентов с основными фатальными БЦ. Не меньшее значение в прогрессировании основных смертельных БЦ имеет растущий дефицит жизненно необходимых продуктов питания и питьевой воды в странах Африки и Азии. Это приводит к голоданию значительной части населения в этих регионах планеты. Не менее грозными для здоровья населения нашей планеты являются глобальное потепление, мировые природные катастрофы, связанные с наводнениями в Китае, Индии, Индонезии и Латинской Америке, а также с разрушительными землетрясениями (Турции, Японии и Индонезии), цунами и другими климатическими катаклизмами. Поэтому все мировое здравоохранение во главе с ВОЗ ищет новые эффективные пути решения и устранения медицинских последствий постоянно увеличивающихся природных, экологических и техногенных катастроф и войн, а также инновационные способы борьбы с БЦ и профилактики их прогрессирования. Системным решением этих глобальных мировых угроз человечеству большинство ученых и организаторов здравоохранения высокоразвитых стран считают разработку и создание ПМ новой генерации, способной на новом биотехнологическом уровне преодолеть стоящие перед человечеством вызовы и проблемы.
К сожалению, пока еще не найдено конкретных точек оптимального приложения технологий ПМ в клинической практике, но именно на ПМ возлагаются основные надежды ученых, врачей и пациентов. Исследователи говорят о перспективах ее использования в фармакогеномике, создании генотерапии, генной инженерии, тканевой инженерии, биоинженерии, протеом-основанной терапии, персонализированной иммунотерапии и т. д., а также о надвигающейся эре геноориентированной терапии. Неопределенность точек приложения ПМ привела к неразрешимому биотехнологическому тупику в современных научных исследованиях и пока крайне низкой клинической эффективности подобного лечения при большинстве сердечно-сосудистых, онкологических, аутоиммунных, нейродегенеративных и наследственных БЦ. Эти обстоятельства требуют разработки и создания новых, перспективных и нестандартных научно-методологических индивидуализированных подходов к лечению этих смертельных заболеваний и поиска новаторских методологических подходов к их профилактике и снижению себестоимости этих технологий.
В этой книге мы впервые попытались говорить о ПМ не с позиций перечисления ее будущих достоинств и возможности преодоления существующих недостатков современной медицины, а с позиций работы практического врача. Мы хотели показать в этой монографии уже существующие современные возможности ПМ в лечении пациентов, опираясь на технологии фундаментальной молекулярно-биологической науки, которая меняет современные научные представления о медицинской науке будущего в целом. Американский писатель Уильям Гибсон изрек крылатую фразу: «Будущее уже наступило, просто оно еще неравномерно распределено». Это в полной мере относится к ПМ. Компоненты будущей ПМ существуют уже сегодня в здравоохранении России и других стран мира, а в этой книге мы хотели показать их большому количеству читателей.
ПМ, с одной стороны, уже сегодня рассматривается целым рядом исследователей как разновидность лабораторной медицины, которая применяет большой спектр ОМИК-технологий на практике. С другой стороны, достаточно много в последние годы говорилось о профилактическом, прогностическом и индивидуалистическом методологическом подходе ПМ к пациенту, и это формирует так называемый исследователями пациентоориентированный подход. С третьей стороны, исследователями уже сформулирован для ПМ «принцип 4П», согласно которому 4П-медицина интегрирует в себе понятия персонализации (индивидуальный подход к каждому пациенту), предикции (выявление предрасположенности к развитию заболевания), превентивности (предотвращение появления заболеваний), партисипативности (мотивированное участие пациента). Как мы видим, все три существующих подхода тесно связаны между собой, и прослеживается отчетливая тенденция трансформации пациентоориентированной медицины в персонализированную 4П-медицину (Харисов А. М., Сухотерин А. Ф., Селезнёв П. С. с соавт., 2019) с дальнейшей трансформацией последней в лабораторную медицину нового поколения, основанную на биочипах и генетике. А разработка и применение биочипов дают возможность радикально трансформировать лабораторную медицину, проводить исследования массивов биомаркеров, реализуя подходы и представления ПМ. Сегодня учеными рассматриваются основные области применения микробиочипов в лабораторной медицине: лабораторная диагностика, классификация и прогноз течения заболеваний, анализ механизмов биологических процессов. Перспективным направлением в использовании биочипов является идентификация наследственных мутаций в геноме человека, вызывающих различные заболевания, прежде всего онкологические и ответственные за биотрансформацию лекарственных средств, в частности применяемых в химиотерапии опухолей, а также одновременное выявление различных инфекционных агентов (вирусы, микроорганизмы, грибы и т. д.) и их антибиотикорезистентных форм. В настоящее время показана роль биочипов как инструмента в генетических исследованиях, технологиях генотипирования, широкомасштабных международных проектах исследований полногеномного скрининга ассоциаций (GWAS). Мы попытаемся в этой монографии показать, что диагностика патоспецифических генетических полиморфизмов не есть предел возможностей и главное достижение современной ПМ. Мы попытаемся показать возможности использования результатов генетических и протеомных исследований человека для осуществления геноориентированной и протеом-основанной диагностики и эпигенетического лечения. Предложенный нами подход открывает новые перспективы ПМ, которые ранее не использовались.
В рамках утвержденного председателем Правительства Российской Федерации (Резолюция № ДМ-П8—5 от 03.01.2014) «Прогноза научно-технологического развития России на период до 2030 года» отмечено, что ПМ является перспективной моделью развития здравоохранения в России. Изменение парадигмы мышления и ориентации врачей и руководителей здравоохранения с преимущественно лечебно-диагностического на максимально персонализированный и предиктивно-превентивные подходы при активном участии пациентов потребует от государства и общества серьезных усилий, но в условиях все большего внимания к качеству жизни и особенностям демографической ситуации необходимость обеспечения персонифицированного подхода должна стать национальным приоритетом (Пальцев М. А., Белушкина Н. Н.,Чабан Е. А., 2015).
Сегодня о ПМ, или о 4П-медицине, мы говорим просто как о совсем новом, системном, фундаментальном молекулярно-биологическом явлении в мировом здравоохранении. Концепция 4П-медицины является не столько революцией, сколько этапом эволюции современной модели здравоохранения, в которой в той или иной степени применяются все подходы 4П-медицины. Однако лишь взаимопроникновение всех четырех принципов 4П-медицины является необходимым условием формирования качественно новой персонализированной модели здравоохранения (Hamburg M. A., Collins F. S., 2010; Jorgensen J. T., 2015).
В настоящее время многие фармацевтические компании сделали ПМ центром своей стратегии. Так, сегодня большинство крупнейших фармацевтических компаний уже начали внедрять принципы персонализации в исследования и разработки биомедицинских технологий. Лидирующие позиции в этой области занимают компании Roche, Novartis, Pfizer и др. Согласно оценкам медицинского исследовательского центра Университета Тафтса (Tufts University), от 12 до 50% текущих исследований фармкомпаний приходится на ПМ. По данным Price Waterhouse Coopers, объем рынка лекарственных средств для ПМ в США с 2010 по 2015 год практически удвоился и достиг 425 млрд долларов. При прогнозируемом объеме мирового рынка 1,2 трлн долларов к 2016 году доля персонализированных средств должна была составлять треть всех препаратов (www.pwc.ru), объем мирового рынка увеличился до 1,6 трлн долларов США к 2022 году.
Золотым стандартом персонализированного подхода большинство медицинских и фармацевтических специалистов считают препарат герцептин для лечения рака молочной железы с избыточным количеством рецептора НЕR2 на поверхности клетки. Герцептин вышел на мировой рынок еще в 1998 году. Стимулом для создания лекарства стало открытие гена, кодирующего рецептор НЕR2. Выяснилось, что поломка в этом гене многократно увеличивает количество рецепторов и позволяет им, как заевшей пластинке, беспрестанно посылать сигнал клетке на деление, а это вызывает развитие одной из самых агрессивных форм рака молочной железы. Такие мутации выявляются примерно в 25% случаев. И именно для этих пациенток создавался герцептин — антитело, призванное блокировать этот сигнал. Первые же клинические исследования показали, что применение герцептина для группы больных с НЕ1^2-положительным раком молочной железы дает значительный эффект, увеличивая выживаемость без признаков заболевания и побочных эффектов, характерных для традиционной терапии. Позже выяснилось, что рак желудка, где развитием опухоли в основном управляет тот же рецептор, тоже хорошо поддается лечению герцептином (www.pwc.ru).
В этой книге предпринята попытка обосновать геноориентированную и протеом-основанную диагностику и построить персонализированное эпигенетическое лечение на новом фундаментальном научном факте, выявленном нами при большинстве БЦ и старении, имея в виду так называемое «клональное кроветворение», или «клональный гемопоэз».
Раньше в медицине имело место очень ограниченное клиническое содержание термина «клональный гемопоэз», он применялся исключительно в онкогематологии, и нигде более. Клональный гемопоэз (КГ) был определен онкологами и гематологами всего мира как фундаментальный механизм патогенеза и исключительная прерогатива в возникновении злокачественных онкогематологических заболеваний (острых и хронических лейкозов, лимфом, миеломной болезни и др.), который проявлялся в виде формирования патологических клонов гемопоэтических (кроветворных) стволовых клеток (ГСК) и манифестировал в форме моно- или олигоклонального кроветворения. Известно, что именно понимание КГ как центрального звена патогенеза различных форм рака крови и лимфатической системы позволило онкогематологам создать инновационную медицинскую технологию трансплантации костного мозга (ТКМ) и/или трансплантации гемопоэтических стволовых клеток (ТГСК). Применение впервые в истории медицины в области онкогематологии технологии ТКМ и трансплантации ГСК позволило полностью излечить рак крови у человека еще в середине 60-х годов XX века. Эти сенсационные результаты мировой онкогематологии, свидетельствующие о полном излечении человека от рака крови, стали эталоном современной онкологии и гематологии и открыли новую эру высокоэффективной противоопухолевой терапии в мировом здравоохранении. Считалось, что патологическое клональное кроветворение и формирование патологических клонов ГСК, диагностированных на геномном уровне еще в 60—80-х годах прошлого века и уточненных в начале XXI века, — это исключительно патогенетический механизм злокачественных гематоонкологических болезней и к другим болезням этот феномен не имеет никакого отношения. Такой медицинской проблемы, как КГ при аутоиммунных, нейродегенеративных, наследственных заболеваниях и опухолях солидных органов, которая обсуждается в этой монографии, как масштабной и не нерешаемой научной и важной народно-хозяйственной проблемы медицинской отрасли не существовало в медицине в принципе. Поэтому ее изучением, диагностикой и лечением в неврологии, онкологии, иммунологии и кардиологии никто и никогда не занимался. Роль кроветворения в патогенезе неонкогематологических и неинфекционных болезней цивилизации не рассматривалась по определению, как несущественная и абсолютно незначимая. Гемопоэтическая стволовая клетка (ГСК), по мнению большинства ведущих онкоиммунологов и специалистов по иммунологии гемопоэза (Тупицын Н. Н., 2021), рассматривалась как главное звено в репродукции 36 млрд клеток крови и иммунной системы, и на этом, по мнению патриархов мировой гематологии и трансплантологии, их главная и основная миссия и функция в организме полностью заканчивалась. К концу 20-х годов XXI века в научной медицинской литературе ГСК стали впервые позиционировать как центральные регуляторные и жизнеобеспечивающие системы организма человека, а также как системы иммунологической памяти и клеточные системы активного долголетия и антиэйджинга (Брюховецкий А. С., 2023, Брюховецкий А. С., Шурдов М. А., 2023).
В 2020—2022 году в ведущих мировых научных журналах (J. Nature, J. Nature Genetic, J. Blood и др.) вышла серия публикаций о том, что КГ является важнейшим фактором, и генетической основой процесса старения, и фундаментальной причиной большинства сердечно-сосудистых болезней человечества. И этот научный факт привлек к проблеме КГ пристальное внимание ученых всего мира. Но, как оказалось в дальнейшем, в результате наших собственных исследований, КГ — это также важнейший системообразующий научный феномен, лежащий в патогенезе большинства известных аутоиммунных болезней, нейродегенеративных заболеваний, наследственных болезней и ряда солидных опухолей. Именно этот молекулярно-биологический феномен нам удалось обнаружить при целом ряде неизлечимых прогрессирующих болезней цивилизации, показать его роль в 45—50% внезапных смертей у человека и его фатальное значение при старении человека (Брюховецкий А. С., Шурдов М. А., 2023).
Целью написания этой книги стало не столько монографическое освещение отдельной научной проблемы ПМ и фундаментальной роли КГ для ее реализации и осуществления на практике, сколько разработка понятийного аппарата этого малоизвестного научного явления, алгоритмов молекулярно-биологической диагностики КГ при различных БЦ и создание нового терапевтического метода ПМ для блокирования КГ и истощения CHIP-клона ГСК у этих контингентов пациентов с целью остановки прогрессирования смертельных заболеваний и профилактики их рецидивов.
Книга была написана автором в течение 12 месяцев, но для ее создания и написания он вдохновлялся 30-летней собственной исследовательской деятельностью и многолетней работой других соавторов (Богачёва С. С. и Шурдова М. А.), без которых никогда бы не состоялась разработка биотехнологии геномного балансирования, положенная в основу всех дальнейших клинических разработок авторов. Центральной главой и стержнем всей монографии стала глава №5 «Технология геномного балансирования хроматина гемопоэтических стволовых клеток человека». Появление этой важнейшей главы имеет определенную предысторию, и в предисловии к этой книге авторам хотелось бы на ней остановиться более подробно.
Основным идеологическим и научно-методологическим источником и главной составной частью формирования современной теории КГ при фатальных болезнях цивилизации стали фундаментальные работы по геномике ГСК, выполненные научным коллективом Стэнфордского университета, и в первую очередь это изыскания S. Jaiswal. Работы этой научной группы позволили по-новому посмотреть на проблему клонального гемопоэза. Другим источником знания, позволившим переосмыслить проблему КГ, были работы новосибирских ученых-генетиков под руководством д. б. н. С. С. Богачёва и к. б. н. М. А. Шурдова, которые были опубликованы еще в 2000—2008 году (Лихачёва А. В., Богачёв С. С., Шурдов М. А., 2008). Именно они были положены в основу наших дальнейших, крайне сложных, поисковых научных изысканий и клинических исследований проблемы КГ. Непосредственное личное общение авторов монографии с д. б. н. С. С. Богачёвым и с к. б. н. М. А. Шурдовым и чтение их трудов 15-летней давности, а также использование их последних экспериментальных наработок для научного обоснования предложенной технологии позволило рассматривать их полноценными авторами этой важнейшей главы.
Еще несколько лет назад в планы авторов этой монографии, даже теоретически, не входило исследование проблемы КГ и написание совместного научного труда в области диагностики и лечения КГ при фатальных, неизлечимых неинфекционных болезнях цивилизации. Это было связано с тем, что КГ не рассматривался нами в какой-либо связи с неврологической и аутоиммунной патологией, а также патогенезом солидных опухолей, чем активно занималась наша научная группа. Более того, эта книга могла бы вообще не выйти в свет, как и не появилась бы в клинике предложенная в ней перспективная медицинская биотехнология ex vivo геномного балансирования хроматина ГСК и технологии персонализированной реституции костного мозга (ТПР КМ) для эпигенетической терапии целого ряда фатальных сердечно-сосудистыx, онкологических, аутоиммунных, нейродегенеративных и наследственных болезней цивилизации, осложненных КГ, если бы не случайное стечение неблагоприятных жизненных обстоятельств, странных знаков мироздания и планетарных процессов, благодаря которым ее авторы на финальном этапе своих жизней познакомились друг с другом, начали работать вместе и с головой ушли в творчество и научные исследования. Авторы этой главы соединили в единый технологический процесс лечения смертельно больных людей свой научный, финансово-экономический и биотехнологический потенциал, многолетние собственные научные и практические наработки в области теоретической физики, молекулярной биологии, генетики, генной инженерии, геномики, транскриптомики, протеомики, метаболомики, регенеративной и персонализированной медицины. Каждый из авторов этой главы книги многие годы (более трех десятков лет) самостоятельно разрабатывал фундаментальные основы этих технологий в тысячах километров друг от друга и даже не подозревал, что ее величество Судьба, Случай или сам Господь Бог столь странным и необычным образом распорядится их опытом, их знаниями и умениями. Бытует мнение, что ничего случайного в жизни человека не бывает, а все случайности являются закономерными и предопределенными заранее! По-видимому, эта встреча была нам всем очень нужна, и возможно, была уготована нам свыше. В любом случае мы рады этому факту и благодарим Всевышнего за его помощь!
В научном мире и среди широких слоев населения бытует мнение, что новаторские идеи приходят в головы только очень молодым и талантливым людям, так как у них якобы «очень пластичен мозг» и они способны «очень нестандартно мыслить» и «находить асимметричные и альтернативные решения». Авторы разработки новой биотехнологии, описанной в 5-й главе книги, как и все основные авторы монографии, являются прямой противоположностью этой известной догмы и авторами патента на изобретение, охраняющего созданную ими интеллектуальную собственность. В этой главе монографии были предложены ряд крайне не-стандартных и даже принципиально отличных от известных мировых научных подходов, теоретических и технологических решений серьезной проблемы лечения и профилактики смертельных болезней цивилизации, и это позволяет нам говорить, что и в пожилом возрасте у некоторых ученых еще не окончательно утрачен научный потенциал и научно-исследовательский задор, если исследователи ставят перед собой амбициозные научные цели, то они способны делать все возможное для их осуществления и практической реализации.
Авторы 5-й главы монографии познакомились друг с другом в тот поздний период жизни, когда все мы уже были пожилыми людьми (всем за 60) и, в общем-то, уже состоявшимися в жизни, обществе и науке специалистами и профессионалами, с научными степенями и академическими званиями и абсолютно разным мировоззрением, исследовательскими интересами и научными представлениями. За плечами каждого из нас был уже такой большой жизненный и практический опыт научных побед, горьких разочарований и определенная научная и производственная карьера, что впору каждому из нас было создавать свою научную школу или свое направление в отечественной науке или промышленности. Но это нисколько не помешало нам объединить свои творческие и далеко «не молодые» усилия и с большим удовольствием начать заниматься новым интересным делом — созданием новаторской технологии геномного балансирования хроматина ГСК. Нас всех объединила и сплотила грандиозная инновационная научная идея разработки и создания инновационной технологии лечения смертельных и пока неизлечимых болезней цивилизации и возможность увеличения продолжительности жизни человека при БЦ человека. Если быть до конца откровенными, то где-то в глубине души мы создавали технологию для реставрации наших собственных постаревших организмов, позволившую нам или, возможно, нашим детям увеличить продолжительность и улучшить качество собственной жизни и преодолеть надвигающиеся в ближайшем будущем и на нас возрастзависимые фатальные болезни цивилизации и неминуемую старость.
Известно, что с возрастом и выходом на заслуженную пенсию большая часть ученых самых различных специальностей из академической науки и производственного сектора не создают чего-то нового в своих научных дисциплинах, а пытаются приложить свои фундаментальные и прикладные знания в математике, физике, молекулярной биологии, генетике и других науках для создания технологий сохранения здоровья и новаторского лечения человека. Они пытаются в финале своей жизни дать человечеству и миллионам больных людей в мире что-нибудь, на их взгляд, крайне полезное и нужное для сохранения и поддержания их здоровья, опираясь на то, что они сделали в молодом возрасте. Примеров этому по всему миру очень много. Возможно, что на старости лет это бы произошло и с нами! Но все получилось абсолютно наоборот!
Достаточно пожилые люди и ученые самых разных специальностей, написавшие как патент РФ на изобретение, так и 5-ю главу (один из нас физик-теоретик, занимающийся электротехникой, с биологическими интересами и опытом работы с ДНК, другой молекулярный биолог с генетическим уклоном, генно-инженерными способностями и фармацевтическими навыками, а третий врач-невролог с 40-летним стажем, увлекающийся клеточными технологиями, регенеративной медициной, молекулярными аспектами онкологии и аутоиммунных болезней), попытались совершить мозговой штурм, способный обеспечить научный прорыв в здравоохранении и найти свое нестандартное и абсолютно асимметричное решение в области ПМ, в диагностике и лечении неинфекционных БЦ человека. Мы попытались разработать прорывную биомедицинскую технологию геномной балансировки хроматина ГСК, альтернативную геномному редактированию и аллогенной трансплантации костного мозга, и стать пионерами принципиально нового научного направления в современной медицине — персонализированной эпигенетической терапии, реституции (восстановления как до болезни) костного мозга и/или реституции гемопоэтических стволовых клеток.
Саму невероятную идею возможности восстановления до предболезненного состояния (реституции) поврежденной гемопоэтической стволовой клетки (ГСК) 30 лет назад высказал соавтор 5-й главы к. б. н. Михаил Аркадьевич Шурдов, когда он работал научным сотрудником на НПО «Вектор» в г. Новосибирске, занимался изучением структуры ДНК человека и защитил кандидатскую диссертацию на эту тему. В одном из своих альпинистских походов в горах Киргизии, совместно с одним из своих коллег-биологов в традиционном «споре ученых у костра», им был придуман принцип природоподобного восстановления одноцепочечных разрывов ДНК в клетках эукариот путем создания специальных базовых условий (СБУ), в которых клетка способна сама себя реставрировать, если ее обеспечить фрагментами двуцепочечных ДНК (дцДНК) здорового донора и создать ей определенные условия для саногенеза.
В дальнейшем уже в XXI веке этот подход в генотерапии стал называться генной модуляцией. Но еще в 2000-х годах биоматериалом для получения ДНК М. А. Шурдовым была предложена плацента здоровых женщин. М. А. Шурдов потратил много сил, времени (почти 15 лет) и более сотни миллионов рублей собственных финансовых средств для изучения лекарственной субстанции из фрагментированных дцДНК человека. Эти полученные данные позволили зарегистрировать ее в Министерстве здравоохранения России как лекарственную субстанцию «Панаген»ТМ. На этом этапе работы неоценимую помощь и всю тяжесть фундаментальных научных исследований взял на себя еще один соавтор этой главы д. б. н. С. С. Богачёв, который вместе с коллективом своих учеников на молекулярном уровне доказал физическую возможность реставрации гемопоэтических стволовых клеток (ГСК) и опубликовал в десятках статей в отечественных и зарубежных научных рецензируемых журналах результаты генетического и молекулярно-биологического изучения восстановления поврежденных ДНК при создании специальных базовых условий (СБУ). С. С. Богачёв и М. А. Шурдов сформулировали и опубликовали в открытой научной печати еще в 2008 году концепцию «искусственной рекомбинагенной ситуации» в ГСК, когда возможно проведение гомологичной рекомбинации (равнозначной замены) участков поврежденной ДНК в стволовых клетках (СК) человека на дцДНК здорового донора. Они детально описали весь сложный молекулярно-биологический механизм и условия управления этим научным феноменом и показалии его натуральность, ункальность и физиологичность (Лихачёва А. С., Рогачёв В. А., Николин В. П. с соавт., 2008; Лихачёва А. С., Шурдов М. А.,Богачёв С. С., 2008). В своих исследованиях они доказали, что сама Природа или Господь Бог давно создали этот физиологичный внутриклеточный саногенетический механизм реставрации повреждений ДНК в хроматине стволовых клеток путем интернализации (поглощения) двуцепочечных РНК (дцРНК) и дцДНК в цитоплазму и в ядро стволовых клеток (СК) из плазмы крови или из межтканевой жидкости. В январе 2024 года в Бразилии вышла статья, обобщающая эти фундаментальные исследования (Potter E. A., Dolgova E. V.,, Proskurina A. S. et al., 2024). Но этот механизм не работает на дифференцированных клетках человека и животных, а возможен только в низкодифференцированных клетках типа стволовых клеток. В биологические жидкости дцДНК и дцРНК попадают в результате утилизации всех поврежденных клеток в организме пациента путем постоянного апоптоза (программной клеточной гибели).
Главное научное достижение С. С. Богачёва и М. А. Шурдова заключалось в том, что им удалось «подсмотреть в природе» и записать программные алгоритмы этого внутриклеточного репарационного механизма и на молекулярном уровне научиться им управлять in vitro и in vivo на экспериментальных животных. В 2008 году лекарственная субстанция «Панаген» была изучена на эффективность и безопасность в условиях доклиники и клинических исследованиях, была официально зарегистрирована и получила регистрационное удостоверение Росздравнадзора Министерства здравоохранения Российской Федерации. Это была большая победа разработчиков! Начались серьезные клинические испытания таблетированных форм препарата «Панаген», полученного из одноименной субстанции для лечения рака молочной железы. Многие годы молекулярный биолог и генетик, д. б. н. С. С. Богачёв и его научная группа из Лаборатории индуцированных клеточных процессов Новосибирского НИИ цитологии и генетики СО РАН совместно со специалистами Института клинической иммунологии СО РАН под руководством профессора, д. м. н. Е. Р. Черных изучали возможности и перспективы применения данной лекарственной субстанции на доклиническом этапе и в клинике для лечения рака груди. В клинических испытаниях участвовали больные женщины с раком молочной железы. Был показан уникальный клинический результат. У 52% женщин с III стадией рака, которые принимали препарат, в течение пяти лет, на протяжении трех последовательных химиотерапий, рецидивов не произошло. В той группе пациентов, которые не принимали препарат, но в остальном получали такое же лечение, безрецидивная выживаемость составила только 18%. С. С. Богачёв назвал созданную ими технологию словом «Каранахан»: в переводе с санскрита — «убивающий причину». Как утверждает д. б. н. С. С. Богачёв: «Совершенно божественным путем было установлено и поймано то научное явление, что стволовые клетки различного генеза обладают удивительным свойством — они тащат внутрь себя, проглатывают, захватывают экстраклеточные фрагменты двуцепочечной ДНК и используют их для восстановления молекулярной структуры ГСК». В течение более 20 лет С. С. Богачёвым и его учениками проводились молекулярно-генетические исследования «Панагена» и была показана удивительная особенность этой лекарственной субстанции к реставрации поврежденной ДНК путем коммитирования (терминальной дифференцировки) опухолевой стволовой клетки (ОСК) за счет гомологичной рекомбинации (равнозначной замены) мутантных участков ДНК, выявлена способность замещать их на здоровые фрагменты ДНК, что даже позволило блокировать репродуктивность ОСК. Данная работа в 2020 году была удостоена Государственной премии Президента России, присуждаемой молодым ученым в области науки и инноваций, и ее получили молодые ученые этой группы — ученицы д. б. н. С. С. Богачёва.
С 1996 года и по настоящее время один из авторов монографии, профессор, д. м. н. А. С. Брюховецкий занимался изучением возможности применения СК при нейродегенеративных, нейротравматических и онкологических заболеваниях у человека. Эту работу он выполнял в рамках проектов Министерства обороны России при лечении боевой травмы мозга и опорно-двигательного аппарата у военнослужащих, получивших травму головного и спинного мозга в локальных военных конфликтах. Затем А. С. Брюховецкий, являясь координатором отраслевой научно-исследовательской программы Российской академии медицинских наук «Новые клеточные технологии — медицине», применял ГСК для лечения последствий нейротравмы, нейродегенеративных заболеваний и нейроонкологии с 2000 по 2010 год. В 2005 году им было получено на Клинику «НейроВита» первое в мире регистрационное удостоверение Росздравнадзора Минздрава России на клиническое применение медицинской технологии лечения травматической болезни центральной нервной системы (ЦНС) с использованием гемопоэтических стволовых клеток (ГСК). Более 22 лет его частная клиника применяла эту технологию почти у 20 000 пациентов из 30 стран мира. Главной проблемой, с которой столкнулся профессор А. С. Брюховецкий, была низкая эффективность данной технологии для лечения иммуноассоциированных онкологических, нейродегенеративных и аутоиммунных заболеваний. При этом технология показывала блестящие результаты в ситуациях, когда патологический процесс был полностью остановлен, как, например, при лечении последствий травмы головного и спинного мозга и последствий инсультов. Он оформил совместно с д. б. н., к. м. н. Л. Ю. Гривцовой патент на изобретение РФ, в котором показал, как можно выявить на протеомном уровне клональные повреждения ГСК у пациентов с онкологическими, нейродегенеративными и аутоиммунными заболеваниям. Позже он доказал наличие мутаций генов клональности при большинстве аутоиммунных, нейродегенеративных и онкологических заболеваний и подтвердил наличие при этих заболеваниях клонального гемопоэза с неопределенным потенциалом (СHIP). Профессор А. С. Брюховецкий многие годы искал пертурбогены (лекарственные средства, воздействующие на геном), способные перепрограммировать, модулировать и изменить молекулярно-биологическую эпигенетическую структуру и функциональное состояние поврежденных ГСК. А. С. Брюховецким был разработан целый ряд (более 25) патентов на изобретение РФ по созданию молекулярно нацеленных (таргетных) клеточных препаратов, изменяющих регуляторные функции ГСК. Однако все они не решали проблемы коррекции внутренних мутационных повреждений ДНК в ГСК и ГПК пациентов с иммуноассоциированными БЦ человека.
Когда профессор А. С. Брюховецкий присоединился к уже существующему научному коллективу новосибирских, алтайских и московских ученых, возглавляемых С. С. Богачёвым и М. А. Шурдовым, изучил большую часть открытых научных публикаций и их не опубликованные исследования о молекулярных механизмах «рекомбинагенной ситуации» в гемопоэтической стволовой клетке и увидел биотехнологические возможности реставрации клетки, он предложил партнерам по-новому взглянуть на проделанную ими многолетнюю научную работу и применить их достижения не столько для создания таблеток для лечения рака, сколько для восстановления и реставрации молекулярной структуры и коррекции одноцепочечных разрывов поврежденной аутологичной ГСК больного человека при целом ряде иммуноассоциированных болезней цивилизации, в том числе и рака. Он пришел к парадоксальному выводу, что «ученые создали микроскоп, и вместо того, чтобы изучать микромир, они забивают им гвозди»! По мнению профессора А. С. Брюховецкого, научная идея, принадлежащая С. С. Богачёву и М. А. Шурдову, была просто гениальна, универсальна и имела много научных целей для своего прикладного клинического приложения. Он утверждал, что на самом деле М. А. Шурдов и С. С. Богачёв создали инструмент для лечения и восстановления поврежденного эпигенома кроветворной стволовой клетки и его прямое использование может дать шанс на реставрацию молекулярных повреждений эпигенома ГСК у тысяч пациентов с фатальными болезнями цивилизации, проложить новый путь к лечению старения как болезни. А. С. Брюховецкий предложил рассматривать ГСК как новый высокотехнологичный «биологический клеточный препарат» с заданными свойствами, который можно персонализировать и моделировать как новый актуальный терапевтический вариант при иммуноассоциированных болезнях цивилизации с клональным гемопоэзом.
Всех основных участников этого проекта соединил вместе директор ФГБУ НМИТЦ акушерства, гинекологии и перинатологии им. В. И. Кулакова Минздрава России академик РАН, профессор Г. Т. Сухих, который увидел в этом проекте большое будущее и поддержал ученых словом и делом. Именно он предложил М. А. Шурдову и А. С. Брюховецкому, работая вместе, создать инновационную специализированную клинику персонализированной медицины новой генерации, сегодня имеющую название АО Клинический госпиталь «НейроВита». Он был инициатором создания инновационных научных протоколов адоптивной эпигенетической терапии для лечения иммуноассоциированных аутоиммунных, нейродегенеративных, сердечно-сосудистых и онкологических болезней цивилизации.
В экспериментах С. С. Богачёва и его учеников еще в 2008 году подтвердился научный факт того, что можно реставрировать поврежденную ГСК с использованием фрагментов здоровой дцДНК человека, если создать ей специальные базовые условия и полностью или частично восстановить ее функцию как in vitro, так и in vivo. Авторы пришли к выводу, что эта клеточная технология, выполненная ex vivo (вне организма), позволит «подлечить» поврежденную системообразующую кроветворную стволовую клетку и вернуть ее в организм пациента, чтобы сохранить защитные функции иммунитета. Эти минимальные манипуляции с клонами поврежденных ГСК могут позволить остановить болезнь и ее прогрессирование и обеспечить профилактику и отсутствие рецидива болезни у человека на длительный срок. В 1820 году (в XIX веке) ординарный профессор патологии и терапии Клинического института Императорского Московского университета Матвей Яковлевич Мудров предлагал «лечить не болезнь, а больного». В XXI веке стало очевидно, что новаторские технологии геномной и эпигенетической терапии позволяют лечить не только больного и не только его болезнь, но, что самое важное, лечить его системообразующую стволовую кроветворную клетку, которая способна сама восстановить нормальный надзор и контроль иммунитета над всем организмом и справиться с болезнью самостоятельно.
В настоящее время на молекулярно-биологическом уровне возможно восстанавливать и лечить долгоживущие системообразующие клетки человека и тем самым начать управлять врожденным и приобретенным иммунитетом. Сегодня современные технологии позволяют обнаружить причину БЦ в виде КГ на геномно-протеомном уровне и попытаться устранить ее путем блокировки или истощения CHIP-клонов ГСК. Лечение таких больных становится персонализированным, высокотехнологичным и молекулярно-нацеленным на причину и «движущие молекулярно-биологичеcкие силы» болезни. Стало возможно лечить человека не столько «на организменном, органном, тканевом и клеточном уровне его болезни», сколько на молекулярном уровне генома и протеома его долгоживущих и системообразующих стволовых клеток, определяющих его кроветворение и иммуногенез.
В итоге совместной работы авторов как 5-й главы, так и всей книги была сформулирована новая клонально-кроветворная теория возникновения и динамики БЦ и старения, опубликованная в 2023 году в монографии А. С. Брюховецкого и М. А. Шурдова «Старение и антистарение. Медико-биологические подходы к увеличению продолжительности жизни и активному долголетию». На ее основе была разработана и создана новая молекулярно-биологическая (геномная и постгеномная) медицинская биотехнологическая платформа управления иммунитетом путем геноориентированных и протеом-основанных эпигенетических подходов к лечению смертельных БЦ и старения. Многолетние (более 30 лет) исследования всех разработчиков были объединены и сведены А. С. Брюховецким и И. С. Долгополовым в единый программный протокол исследовательских работ и медицинских услуг под названием медицинская технология персонализированной реституции костного мозга с применением способа геномного балансирования хроматина аутологичных ГСК при различных неинфекционных болезнях цивилизации, осложненных клональным гемопоэзом. Технологическая платформа обеспечивает возможность блокирования репродуктивных функций доминирующего в кроветворении патологического клона (клонов) ГСК и ГПК костного мозга. Было показано, что геномная и постгеномная болезнь ГСК формируют моноклональность или олигоклональность гемопоэза (кроветворения), а также впервые было установлено, что мутации генов клональности, формирующие патологический клональный гемопоэз при БЦ, имеют место почти при всех аутоиммунных, онкологических и нейродегенеративных болезнях. При этом имеет место разная структура повреждения генов клональности и выявляются разные дополнительные соматические мутации (ДСМ) этих генов. Было впервые доказано, что именно клональный гемопоэз с неопределенным потенциалом является основным «мотором болезни» и «биологическим двигателем», возбуждающим и поддерживающим этиопатогенез большинства онкологических, нейродегенеративных и аутоиммунных БЦ человека. Эффектом применения данной технологической платформы стало доказанное на геномном и протеомном уровне реальное изменение системного иммунного ответа организма пациента с БЦ путем смены моноклонального кроветворения на поликлональность гемопоэза.
Следует отметить, что разработанная новая биотехнология персонализированной реституции костного мозга, также созданная с применением лекарственной субстанции «Панаген», тоже могла бы называться «Каранахан-2», так как она также решает абсолютно ту же задачу, что и таблетки «Панаген» для лечения рака молочной железы. Технология реституции костного мозга (РКМ) также является «убивающей причину» основных болезней цивилизации с клональным гемопоэзом. Она обеспечивает деплецию (истощение) и эрадикацию (исчезновение) доминирующего патологического клона ГСК, блокирует, вырождает и «сводит на нет» потомков патологического клона (клонов) кроветворения, активируя заложенные в эмбриогенезе, но ингибированные ранее болезнью клоны здоровых ГСК. Блестящие фундаментальные исследования сотрудников академической новосибирской научной школы, руководимой д. б. н. С. С. Богачёвым, в молекулярно-биологическом изучении «феномена гомологичной рекомбинации» в ГСК показали невероятный потенциал коммитирования и молекулярной реставрации поврежденной ДНК в клетках-предшественниках лекарственной субстанции «Панаген». Новосибирские ученые доказали определяющее реставрационное влияние лекарственной субстанции «Панаген» на доминирующие патологически клоны ГСК и активацию молекулярной структуры и функциональности ранее ингибированных клонов гемопоэтических стволовых и прогенеторных клеток в специальных базовых условиях (СБУ). Коммитирование патологического клона ГСК путем инкубации с лекарственной субстанцией «Панаген» приводит, с одной стороны, к нарушению его репродуктивных способностей, а с другой стороны, к полному истощению (деплеции) и исчезновению из циркулирующей крови иммунокомпетентных клеток доминирующего клона ГСК в течение 6—8 месяцев. Этот феномен был подтвержден авторами монографии в научном исследовании экспериментально на мышиных трансгенных моделях болезни Альцгеймера и бокового амиотрофического склероза. У трансгенных мышей с моделью БАС и БА была выполнена реституция костного мозга на базе вивария Федерального исследовательского центра «Института биологически активных веществ» РАН (г. Черноголовка Московской области). Было экспериментально показано, что именно наличие доминирующего СHIP-клона ГСК в костном мозге и периферической крови модельных животных и человека с БЦ является той «смертельной петлей иммунитета», которая неуклонно поддерживает патогенез этих болезней и в итоге убивает пациентов. В эксперименте СHIP-клон ГСК был блокирован и истощен с использованием лекарственной субстанции «Панаген» в СБУ, и это позволило значительно отсрочить наступление запрограммированного возникновения симптомов наследственной болезни у трансгенных животных и значительно увеличить продолжительность жизни модельных животных с генетическим дефектом.
Оказалось, что проблема клонального гемопоэза или CHIP при всех БЦ является фундаментальной и системообразующей и является первостепенной для запуска и прогрессирования этих болезней. В эксперименте нами был установлен факт наличия СHIP при всех БЦ, и, соответственно, наличие так называемой «смертельной иммунной петли» при целом ряде БЦ было нами полностью подтверждено. Однако было абсолютно непонятно теоретически и технологически, как решать эту проблему на практике у человека. Существующие терапевтические подходы к СHIP большинство исследователей предлагают реализовать путем стратегии блокировки СHIP (Jaiswal S., 2020). B. Haring, A. P. Reiner, J. Liu et al. (2021) технически блокаду CHIP предлагают реализовать через подавление интерлейкина-6/интерлейкина-1β с целью предотвращения развития атеросклеротического поражения и накопления дальнейших соматических мутаций на ранних субклинических стадиях заболевания. S. K. Pasupuleti, B. Ramdas, S. S. Burns et al. (2023) предложили изменять структуру СHIP путем геноориентированного подавления провоспалительных цитокинов, продуцируемых генами клональности, используя моноклональные антитела к ним и другие фармпрепараты. Установлено, что провоспалительное состояние может потенцировать прогрессирование CHIP в более значимую гематологическую неоплазию. Блокаторы кальциевых каналов нифедипин и SKF-96365, как отдельно, так и в сочетании с метформином, MCC950 или анакинрой (антагонистом рецептора IL-1), подавляли рост мутантных клеток CHIP и частично восстанавливали нормальный гемопоэз. Нацеливание этих препаратов на CHIP-мутантные клетки может стать потенциальным терапевтическим подходом для лечения CH и связанных с ним нарушений у людей с ожирением.
Недавно технология CRISPR была использована для оценки последствий инактивации мутаций в TET2 СHIP и DNMT3A СHIP (Sano S., Oshima K., Wang Y. et al., 2018). Инактивация DNMT3A СHIP или TET2 СHIP приводила к увеличению экспрессии цитокинов, но эффекты различались качественно и количественно, что позволяет предположить, что они оказывают ген-специфическое действие. Хотя инактивация DNMT3A приводила к большей гипертрофии сердца и усилению фиброза после введения ангиотензина-II, TET2-опосредованный CHIP приводит к повышению регуляции интерлейкина-6/интерлейкина-1β, поскольку TET2 действует как негативный регулятор активации провоспалительных макрофагов и индуцирует атеросклероз (Fuster J. J., MacLauchlan S., Zuriaga M. A. et al., 2017; Sano S., Oshima K., Wang Y. et al., 2017). С другой стороны, генетически сниженная передача сигналов интерлейкина-6 может снизить риск сердечно-сосудистых заболеваний у носителей CHIP-клонов (Sano S., Oshima K., Wang Y. et al., 2020). Однако решение об инактивации CHIP существует и его диктует клиническая медицина!
В руководстве для врачей по анестезиологии и реанимации существует базовое правило: «Прежде чем спасать повешенного, его вынимают из петли». Действительно глупо осуществлять реанимационные мероприятия человеку, у которого дыхательные пути механически перекрыты веревочной петлей. В этом случае здравый смысл подсказывает, что врачу-реаниматологу необходимо убрать физическое препятствие в виде петли на шее для доступа воздуха в легкие. Аналогичная ситуация, на наш взгляд, имеет место при большинстве иммуноассоциированных БЦ с СHIP. Врачу необходимо убрать «смертельную иммунную петлю» в виде СHIP, которая своим существованием уничтожает живой организм. Технология ex vivo геномного балансирования хроматина позволяет реставрировать поврежденную ГСК и нивелировать основной патогенетический эффект патологического клона ГСК. Она позволяет убрать системное иммуноагрессивное или иммунотолерантное действие иммунокомпетентных клеток (ИКК), потомков патологического клона ГСК и тем самым устранить «фатальную иммунную петлю», приводящую к летальному исходу при большинстве иммуноассоциированных онкологических, аутоиммунных, нейродегенеративных БЦ человека, отягощенных клональным гемопоэзом.
Впервые в этой монографии авторы попытались составить «молекулярно-биологический портрет» доминирующих патологических CHIP-клонов ГСК на основе анализа мутаций генов клональности при разных клинических нозологиях и доказать в клинике реальную возможность существования и смены моно- или олигоклональности гемопоэза на поликлональное кроветворение на молекулярно-генетическом и протеомном уровне. То есть предложенная авторами технология геномного балансирования хроматина в ГСК практически устраняла фундаментальную причину болезни — клональный гемопоэз с неопределенным потенциалом и открывала возможность для последующего восстановления (реституции) поврежденной ткани костного мозга и восстановления ее до состояния как до болезни. Поликлональность кроветворения — вот главная цель применения предложенной технологии реституции поврежденных ГСК с наличием СHIP. Именно поликлональность гемопоэза является основой здоровья человека, и как гласит старая китайская мудрость: «Гармония в природе возникает только тогда, когда на поле могут расти все цветы». Интерпретируя эту старую китайскую мудрость под проблему клонального гемопоэза, очевидно, что нужно попытаться восстановить работу большинства ранее ингибированных (подавленных) клонов ГСК костного мозга в формировании и производстве всего пула 36 млрд циркулирующих клеток крови в живом организме человека. Это и будет стратегическим решением неразрешимого парадокса клональности кроветворения!
В книге проведен серьезный анализ научной литературы по проблеме клонального гемопоэза и впервые на собственном клиническом материале было показано его наличие при самых различных болезнях цивилизации: при нейродегенеративных заболеваниях (боковом амиотрофическом склерозе, системной нейродегенерации головного мозга, при болезни Альцгеймера и т. д.), при аутоиммунных заболеваниях (сахарном диабете 1-го типа, ревматоидном артрите, системной красной волчанке и др.), при различных злокачественных солидных опухолях (раке легкого, раке молочной железы) и нейроэндокринных опухолях (нейроэндокринный рак кишечника и т. д.), а также при целом ряде наследственных болезней (альфа-талассемии, болезни Шарко — Мари — Тута). Ранее клональный гемопоэз был описан преимущественно при миелопролиферативных онкогематологических заболеваниях (миелобластных лейкозах, различных типах лимфом, миелоидной болезни и др.), а также при большинстве сердечно-сосудистых заболеваний (стенозирующий системный атеросклероз, инфаркт миокарда и инфаркт мозга). То, что в основе большинства болезней цивилизации лежит клональный гемопоэз, стало даже для нас большим откровением. Но именно этот научный факт патологической клональности при БЦ, обнаруженный нами в собственных исследованиях, позволил по-новому подойти к пониманию проблемы и предложить новое решение персонализированного лечения БЦ.
Авторы книги выражают искреннюю благодарность коллективам своих предприятий, без которых проведение столь масштабных исследований без государственной финансовой поддержки и написание этой книги было бы просто невозможно, а также благодарят профессора, д. м. н. И. С. Долгополова за замечания при прочтении книги и помощь в научном редактировании этой монографии. Авторы благодарят руководителя генетической лаборатории ФГБУ НМИЦ радиологии Минздрава России, к. б. н. П. А. Шаталова и специалиста-генетика, к. б. н. М. П. Райгородскую за плодотворную работу по проведению полноэкзомного секвенирования 22 000 генов человека и анализ мутаций генов клональности у больных с БЦ с клональным гемопоэзом. Мы благодарим директора Института репродуктивной генетики ФГБУ НМИЦ акушерства, гинекологии и перинатологии Минздрава России, членкора РАН, профессора Д. Ю. Трофимова за помощь в оценке полученных геномных данных и понимании сути генетических результатов. В этой исследовательской работе большую помощь оказала руководитель отдела иммунологии МНРЦ им. А. Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России д. б. н., к. м. н. Л. Ю. Гривцова. Проведенные ею протеомные исследования и молекулярно-биологический анализ мембранных антигенов ГСК с использованием проточной многоцветной цитометрии были очень нестандартными и подробными, а научные дискуссии с ней были очень полезными и поучительными, за что автор ей очень благодарен и признателен.
Автор надеется, что читатели поймут и примут наши новые научно-методологические подходы к геноориентированной и протеом-основанной эпигенетической терапии БЦ и реституции костного мозга, изложенные в данной монографии, и с пониманием отнесутся к нашим высокотехнологичным терапевтическим инновациям в лечении смертельных болезней цивилизации. Мы доказали, что эти новаторские подходы работают как в эксперименте, так и в клинике, и в целом ряде случаев позволяют остановить прогрессирование большинства смертельных БЦ с клональным гемопоэзом, а механизм их работы, несомненно, будет окончательно установлен в будущем. Мы очень верим, что разработанный нами подход к восстановлению врожденного иммунитета при целом ряде фатальных онкологических, аутоиммунных, нейродегенеративных и наследственных БЦ будет с пониманием принят научной общественностью и получит дальнейшее развитие при лечении целого ряда этих смертельных заболеваний человека.
Автор
Введение
Одним из ведущих мировых трендов в развитии современной системы здравоохранения является персонализированная медицина (от англ. personalized medicine) — также называемая персонифицированная медицина, прецизионная медицина, индивидуализированная медицина, которая представляет собой совокупность высокоточных методов профилактики патологического состояния, диагностики и лечения в случае его возникновения, основанных на индивидуальных особенностях пациента. К подобным индивидуальным особенностям относят генетические, эпигенетические, транскриптомные, протеомные маркеры, а также совокупность вариативных фенотипических признаков — как всего организма пациента, так и его отдельных тканей или клеток (Wikipedia, 2022). Расшифровка генома человека и «генетизация» медицины привела к появлению нового направления в персонализированной медицине — генной терапии, которая базируется на достижениях молекулярной биологии, генной и клеточной инженерии, а также на новых информационных технологиях. Изначально под генной терапией понималось лечение наследственных заболеваний путем коррекции мутантных генов на уровне хромосомной ДНК. Однако сложность проблемы заставила ученых пересмотреть взгляды на данную методологию. К настоящему времени исследователи лишь нащупали подходы к такому решению проблемы (технология химеропластики). Ввиду сложности задачи корректировки повреждений генома, наибольшее распространение получили методы, основанные на введении в организм больного полноценных, функционально активных (терапевтических) генов в составе плазмидной ДНК (Бабаев А. А. с соавт., 2007). В последние годы генная терапия получила новый инструмент коррекции генома, называемый редактирование генов, или редактирование геномов, — это тип генной инженерии, при котором ДНК вставляется, удаляется или заменяется в геноме клеток организма с использованием специализированных программируемых нуклеаз или «молекулярных ножниц» (Ребриков Д. В., 2016). Быстро развивающиеся технологии редактирования генома из научно-исследовательских лабораторий уверенно переходят в клиническую практику. Разработаны принципиально новые методы изменения генома человеческих эмбрионов на ранних стадиях развития, и разрешены к клиническому применению самые дорогостоящие инновационные генотерапевтические препараты. Создан молекулярный инструментарий для исправления генетических нарушений у людей в любом возрасте. Врач, по сути, становится корректором генетической инструкции по построению и функционированию организма человека (Бабаев А. А. с соавт., 2007).
В настоящее время в борьбе со старением человека, при терапии рака и других злокачественных онкологических заболеваний, нейродегенеративных болезней и особенно наследственных болезней предпочтение отдается генотехнологиям. Основные надежды ведущие мировые специалисты в области генотехнологий возлагают исключительно на геномное редактирование. Однако безопасность этих технологий вызывает много вопросов и сомнений, так как нельзя исключить ошибки в расчетах и ятрогенный человеческий фактор. Как говорил великий российский ученый С. П. Королёв (1965), проложивший дорогу в космос: «Там, где есть человеческий фактор, всегда есть высокий риск фатальных ошибок». Поэтому разработка и создание новых, более безопасных технологий генной терапии для персонализированной медицины, основанных на альтернативных геномному редактированию научных принципах работы, приобретает большую актуальность и практическую значимость для клинической практики.
Для решения столь сложной и пока не решенной поставленной задачи надо получить ряд принципиально важных ответов на центральные вопросы проблемы генотерапии. Какие клеточные системы могут и должны стать главным объектом и центральной биологической мишенью современной генотерапии в борьбе со старением и основными болезнями цивилизации (БЦ)? Как правильно доставить генетический материал в соматическую клетку и не повредить ее геном при генной инженерии и генотерапии? Как обеспечить реставрацию генома, но без насильственных исправлений (повреждений) генома и без использования агрессивных интервенций типа «молекулярных ножниц или программируемых нуклеаз» или с помощью векторов, плазмид или вирусов? Как вылечить наследственные болезни, если генетический дефект имеет место в каждой соматической клетке организма человека или млекопитающего уже при его рождении? Нужна ли универсальная, унифицированная технология генотерапии и/или эпигенетической терапии в каждом конкретном случае болезни или нужно создавать персонализированную технологию генотерапевтического лечения?
Абсолютно очевидно, что у уже рожденного человека или млекопитающего с наследственным генетическим заболеванием попытка исправить генетический дефект в каждой клетке организма, даже теоретически, обречена на неудачу и технически невозможна. Но нужно ли делать это? Если организм млекопитающего или человека с генетическим дефектом смог дожить до своего рождения, не умер после рождения и жил долгие годы после рождения, даже не подозревая о болезни, то наличие его генетического дефекта, даже имеющегося во всех клетках организма, не является смертельным приговором для данного организма, и в определенных условиях его геном может быть «генетически стабильным», или, точнее, возможна «молекулярная компенсация» патологически измененного генома. Декомпенсация поврежденного генома тканеспецифических клеток (ТСК) при нейродегенеративных, онкологических, аутоиммунных и наследственных болезнях зачастую приводит к прогрессированию болезни и манифестации клинических проявлений и может привести к смертельному исходу. Причиной декомпенсации болезни и формирования декомпенсации болезни является возникновение неустойчивости генома дифференцированных ТСК. Причиной неустойчивости генома в большинстве случаев является критическое накопление драйверных дополнительных соматических мутаций (ДСМ) в геноме долгоживущих клеток организма: нервных клеток, гемопоэтических стволовых клеток (ГСК), мезенхимальных стромальных стволовых клеток (МССК), половых клеток и др. Так, например, в процессе канцерогенеза драматическое количество ДСМ накапливается даже в здоровом геноме, формирует накопление в клетке патоспецифических белков и проявляется хорошо известной «неустойчивостью генома» высокоспециализированных дифференцированных клеток органов и тканей. При опухолевом процессе «неустойчивость генома» специализированных клеток органов и тканей еще в начале прошлого века отметил Тeodor Bovery (1905). Сегодня онкологи всего мира объясняют появление дополнительных соматических мутаций накоплением онкоспецифических белков (ОСБ) в опухолевых клетках (ОК) (Заридзе Д. Г., 2004). При нейродегенеративных заболеваниях (НДБ) «неустойчивость генома» нейронов разной локализации обусловлена также появлением дополнительных генетических мутаций и накоплением нейроспецифических белков (НСБ) в цитоплазме нейронов различной локализации, то есть в различных высокодифференцированных клетках нервной ткани в головном и спинном мозге (Брюховецкий А. С., 2019). Использование современных молекулярных и клеточных технологий анализа генома в клетках головного мозга при широко распространенных и социально значимых психических заболеваниях (аутизм, шизофрения, болезнь Альцгеймера и др.) показали, что геномная нестабильность представляет собой патогенетический механизм нарушения центральной нервной системы, а также играет роль в развитии ряда болезней головного мозга человека. Генный (геномный) дисбаланс не только нарушает гомеостатическое равновесие нервной клетки, приводя к ее гибели, но и является значимым биологическим маркером нервно-психических заболеваний, позволяющим определять геномные сети, изменения в которых приводят к дисфункции синапсов или нейродегенерации (Тиганов А. С., Юров Ю. Б., Ворсанова С. Г., Юров И. Ю., 2012). «Неустойчивостью генома» клеток миокарда и специализированных клеток сосудистой стенки проявляется формированием атеросклеротических бляшек при накоплении кардиоспецифических белков (КСБ) или вазоспецифических белков (ВСБ) и т. д. (De Majo F. Martens L., Hegenbarth J. C. et al., 2021).
При таком аутоиммунном заболевании (АИЗ), как сахарный диабет 1-го типа, «неустойчивость генома» характерна для бета-клеток поджелудочной железы. И дальше можно продолжать этот список неустойчивых геномов высокодифференцированных клеток при различных заболеваниях очень долго и абсолютно научно обоснованно. Очевидно, что исходом «неустойчивости генома» высокодифференцированных ТСК органов и тканей является дегенерация и последующая атрофия этих клеток (минус-ткань) или, наоборот, процесс сопровождается пролиферацией и патологическим увеличением клеток (плюс-ткань) и манифестирует, например, опуxолевым ростом. Аналогичные процессы неустойчивости генома характерны для всего процесса старения организма.
Основным механизмом, направленным на устранение неустойчивости генома поврежденных высокоспециализированных ТСК и балансировку их геномной неустойчивости, является системная иммунная реакция организма, направленная на устранение этой неустойчивости геномов, формируемая аутологичными гемопоэтическими стволовыми клетками (ГСК). Другими словами, именно ГСК и ее потомки в виде иммунокомпетентных клеток (ИКК) устраняют неустойчивость генома поврежденных ТСК и определяют судьбу этих ТСК. В одном случае это перенаправление ТСК в апоптоз (программную клеточную гибель), в другом — эти клеточные системы подвергаются уничтожению НК-клетками, НКТ-клетками, макрофагами и цитотоксическими лимфоцитами (ЦТЛ), в третьем случае они активируют клетки микроглии или они устраняют «межклеточный мусор» в виде патоспецифических белков, поддерживающий неустойчивость генома ТСК. Также возможен вариант стабилизации генома поврежденных ТСК за счет воздействия цитокинов и биологически активных веществ, секретируемых регуляторными ГСК. В последнем случае ТСК продолжают свое существование в обновленном виде. Поэтому именно ГСК формируют одновременный системный иммунный ответ организма, обеспечивающий выживание организма человека и животных, и именно этим клеткам принадлежит главная и стабилизирующая роль в этом саногенетическом процессе организма. В ряде случаев из-за повреждения молекулярно-биологической геномно-постгеномной структуры аутологичных ГСК они становятся практически не способны выполнять саногенетическую роль молекулярного «стабилизатора» и «успокоителя» неустойчивого генома в пострадавших клетках, и это приводит к прогрессированию БЦ или ее рецидиву.
Примененные нами в этой книге термины «реституция костного мозга» (РКМ) и/или реституция гемопоэтических стволовых клеток (РГСК), вынесенные в оглавление и в предисловие книги, требуют пояснения и обоснования уже во введении к этой монографии. Более того, в этой монографии мы впервые в научной литературе сформулировали основные тезисы инновационного научного медицинского направления в регенеративной медицине и обозначили его именно как реституция костного мозга в терапии аутоиммунных, нейродегенеративных, онкологических, сердечно-сосудистых и наследственных болезней цивилизации с клональным гемопоэзом. Новое теоретическое понимание проблемы клонального гемопоэза, активно разрабатываемое в западной научной литературе в последние годы, и наши более 20-летние исследования гемопоэтической стволовой клетки в патогенезе большинства неврологических и онкологических БЦ и формулирование концепции системообразующей и регуляторной роли CHIP-клона ГСК в формировании большинства клинических проявлений болезней цивилизации позволили расширить и даже дать новое научное определение понятию «реституция костного мозга» и описать клиническое содержание различных стадий реституции КМ и реституции ГСК.
Во введении хотелось бы остановиться на новой терминологии (РКМ и РГСК), примененной в книге. Происхождение самого слова «реституция» берет свое начало еще со времен российского императора Петра I. Реститу́ция — «возвращение, восстановление в прежней должности» — впервые описана у Петра I (см. Смирнов, 263). Вероятно, слово образовано через перевод польского слова restytucja из лат. restitūtiō — то же. Об этом факте упоминается в «Этимологическом словаре русского языка», написанного Максом Фасмером. Термин «реституция» в «Словаре иностранных слов, вошедших в состав русского языка», написанном Ф. Павленковым и вышедшем в свет в 1907 году, обозначал восстановление, возобновление утраченных сил, здоровья; возвращение к прежнему состоянию здоровья, какое было до болезни. Под «реституцией» в «Полном словаре иностранных слов, вошедших в употребление в русском языке» (Попов М., 1907) понималось «восстановление здоровья». Современная «Википедия» за 2023 год определяет термин реституция (от лат. restitutio — восстановление) как «восстановление», но при этом дает различные толкования данного термина «восстановление», в зависимости от области применения данного термина. Подробно на этих аспектах мы остановимся в 7-й главе книги. Здесь мы лишь отметим, что термин «реституция» в медицине далеко не новый и подразумевает полную регенерацию (т. е. замещение дефекта равноценной тканью), а неполную регенерацию врачи называют субституцией. В стоматологии восстановление зубной эмали после повреждения тоже называется реституцией. В акушерстве возвращение повернутой головки плода к ее естественному соотношению с плечами после ее выхода из вульвы называют также реституцией [Restitutio, акт восстановления] (Медицинский словарь Farlex Partner© Farlex, 2012).
По-видимому, именно понимание реституции как «акта восстановления исходного состояния» наиболее правильно отражает медицинскую сущность данного термина. Под реституцией в неврологии понимают формирование саногенетических механизмов при патологии нервной системы, и она является залогом успешности реабилитационных мероприятий, так как сущность саногенетических механизмов проявляется их направленностью на приспособление (адаптацию) к окружающей среде на качественно новом уровне, в связи с имеющимся или имевшимся в организме патологическим процессом. Такими саногенетическими механизмами, которые в тесной взаимосвязи и взаимообусловленности обеспечивают приспособительный эффект, а при патологии — восстановление нарушенных функций мозга, личного и социального статуса больных, являются реституция, регенерация и компенсация. В неврологии и восстановительной медицине эти понятия являются синонимами. Как пишет в своей монографии «Восстановительная медицина» В. А. Епифанов (2013): «Реституция — процесс восстановления деятельности обратимо поврежденных структур» организма человека и животных «путем активации морфологически сохранных, но функционально бездеятельных структур, находящихся в состоянии глубокой депрессии, в значительной степени». Мы считаем, что это самое наукоемкое и научно обоснованное определение медицинского понимания термина «реституция», который отражает суть происходящих процессов в поврежденных органах, тканях и клетках организма и позволяет построить реальные стратегии восстановления повреждений любых органов и тканей. Сущность медицинского термина «реституция» мы сформулировали как «акт восстановления исходного состояния органа или ткани организма человека и животных путем активации ингибированных болезнью ее структурных компонентов и замещение ими поврежденных молекулярно-биологических структур органа или ткани».
При патологии нервной системы реституционные изменения происходят в нервных клетках, нервных волокнах и в структурных элементах нейродистрофически измененных нервных тканей. Реституционные механизмы осуществляются в основном благодаря проницаемости и возбудимости мембран, нормализации внутриклеточных окислительно-восстановительных процессов и активации ферментных систем, следствием чего являются нормализация биоэнергетической и белково-синтезирующей деятельности клеточных структур и восстановление проводимости по нервным волокнам и синапсам. При реституции в нейронных и волокнистых структурах мозга улучшается биоэнергетическое снабжение, нормализуются процессы проницаемости в клеточных мембранах, возрастает биосинтетическая, пластическая и функциональная способность (Епифанов В. А., 2013).
Реституционные механизмы саногенеза в поврежденных органах и тканях достаточно жестко завязаны на кроветворение и иммунитет. Именно системообразующая и регуляторная, управляющая роль ГСК формирует реституционный саногенетический потенциал и сам механизм восстановления поврежденных органов и тканей. Если существует поликлональность гемопоэза (работают около 1000 из 100 000—200 000 существующих клонов ГСК), то саногенетические механизмы организма работают исправно и четко. Однако в процессе жизни или стрессорного воздействия происходит накопление достаточного количества ДСМ в долгоживущих клеточных системах и в стволовых клетках (СК). Часть этих ДСМ в таких долгоживущих клетках, как ГСК, становятся драйверными и драматическими и приводят к формированию клонального гемопоэза и клональной экспансии этих клеток. В крови формируется один или несколько доминирующих клонов кроветворения, которые «выигрывают соревнование» среди других стволовых кроветворных клеток. Постепенно расширяясь в объеме, потомки ГСК и гемопоэтических предшественников доминирующего клона (клонов) кроветворения подавляют ИКК других клонов ГСК всей циркулирующей крови. Иногда количество ИКК доминирующего клона (клонов) ГСК в общей циркуляции клеток крови составляет до 70%, а иногда расширяется до 50—93% и определяет возникновение и манифестацию клинических проявлений большинства фатальных БЦ.
Еще раз уточним и очертим наше понимание клонального гемопоэза с неопределенным потенциалом (CHIP). Мы рассматриваем CHIP как функциональное состояние, пока объем клона составляет более 4% от объема циркулирующей крови (ОЦК). Как только объем CHIP-клона ГСК превышает 10% от ОЦК. это состояние следует рассматривать как геномно-постгеномное заболевание собственных ГСК и главный фундаментальный молекулярно-биологический процесс этипатогенеза большинства иммуноассоциированных неинфекционных болезней цивилизации. CHIP — это основной молекулярно-биологический механизм запуска и прогрессирования большинства иммуноассоциированных болезней цивилизации (БЦ). Если говорить образно, то CHIP, появляясь в ОЦК, изначально является свечой, освещающей преимущества отдельных клонов ГСК в их выживании, но при значительном росте CHIP-клона ГСК эта свеча становится «костром, который запускает и поддерживает своей энергией постоянно кипящий на нем котел патогенеза любой иммуноопосредованной болезни». Его результатом является формирование иммунотолерантного или иммуноагрессивного системного CHIP-ответа собственного иммунитета организма человека и животных на возникновение патологии ТСК и тканей органов и систем. Особенно наглядна эта аналогия CHIP с «костром» наблюдается при нейродегенеративных заболеваниях. CHIP постоянно поддерживает и «подогревает» стойкую патологическую активность и аутоагрессивность иммунокомпетентных клеток крови, которые активируют глиальные клетки, астроциты и микроглию в головном и спинном мозге и формируют хроническое нейровоспаление, которое приводит к повреждению сосудистого обеспечения на уровне артериол и артерий, нарушению синаптических межклеточных контактов и дегенерации нейронов. Другими словами, изначально возникая как преимущество в выживании одних клонов над другими, CHIP является очень полезным приобретением для этого клона, но, если он начинает доминировать в ОЦК и преобладать в репродуктивных функциях, он становится фундаментальной причиной и катализатором патологического процесса в органах и тканях и из положительного фактора превращается в главный инструмент старения и гибели организма.
Чтобы преодолеть основные негативные системные явления, обусловленные влиянием CHIP на органы и ткани, главной стратегией современной медицины может и должна стать стратегия геноориентированной и протеом-основанной эпигенетической терапии, центральным технологическим элементом которой может стать реституция костного мозга и реституция ГСК и CHIP-фокусированная терапия. Она способна обеспечить восстановление здоровья до статус-кво (status quo — возврат в исходное состояние) ГСК костного мозга. В целом ряде случаев эффект частичной реконституции при фатальных БЦ удается получить путем трансплантации костного мозга (ТКМ) или трансплантации ГСК. Однако риск смертельных осложнений от этой высокотехнологичной процедуры составляет до 6—9%, и этот риск смертельных осложнений перекрывает все возможные достоинства этой технологии. Далее в 7-й главе монографии мы объясняем принципиальные различия реституции костного мозга от ТКМ и трансплантации аутологичных и аллогенных ГСК.
Таким образом, реституция костного мозга — это не придуманный нами, вычурный медико-биологический неологизм, а давно известный медицинский термин, являющийся синонимом таких медицинских слов, как «восстановление», «регенерация», «компенсация», «репарация». Новое клиническое содержание термина «реституция» в современной прецизионной (высокоточной) медицине было нами расширено для нужд регенеративной медицины вообще и персонализированной медицины в частности. Это позволило нам предложить принципиально новое решение проблемы восстановления клеточного состава поврежденного костного мозга — восстановление его врожденной поликлональности и иммунологической функциональности, которое было у КМ до болезненного состояния.
Новое научное направление в регенеративной и персонализированной медицине, предложенное нами, в лечении фатальных болезней цивилизации с большим трудом прокладывает себе дорогу в достаточно консервативном и формализованном мировом здравоохранении, регламентированном строгими медицинскими стандартами и клиническими рекомендациями. Мы показали, что CHIP-основанная терапия уже существует в мире, но пока в очень ограниченном объеме (глава 8).
При этом надо отметить, что, несмотря на все трудности творчества и немолодой возраст, авторы от проделанной работы получали большое удовольствие, как от общения друг с другом — приятные эмоции, так и от того, что жаркие научные споры очень стимулировали нашу жизнь, а также приносили радость и удовлетворение от полученных результатов своего труда. Мы творили, «генерили» идеи и создавали новое решение и научное понимание проблемы лечения БЦ. Как в молодости, мы спорили, ругались и пытались создать прорывной и принципиально новый научно-методологический подход к терапии фатальных БЦ и чувствовали себя еще молодыми и нужными! По-видимому, в большинстве своем все получилось, но что-то не пошло. В результате этой интересной работы мы испытывали ощущение причастности к чему-то очень важному, что было крайне необходимым и обнадеживающим стимулом наших исследований и отвлекало от дурных мыслей о надвигающихся проблемах старости и приближающихся возрастзависимых болезнях. Было удивительно и даже забавно видеть, когда пожилые люди так увлеченно спорят друг с другом о будущем мировой медицинской науки и ругаются друг с другом из-за степени доказательности и научной обоснованности того или иного положения предложенной теории, терминологии или этапа технологии.
Итогом этой научной работы, во-первых, стала разработка, создание и патентование биомедицинской технологии реституции костного мозга, а также ее доклиническое изучение и клиническое внедрение в медицинскую практику. Во-вторых, на основании разработки технологии геномного балансирования ГСК доминирующего клона костного мозга была предложена принципиально новая биомедицинская технология реституции костного мозга, которая с новых научно-методологических позиций подошла к реставрации повреждений врожденного иммунитета и управления им. Все работы мы проводили на собственные средства и нисколько об этом не жалеем. Никто из нас не ждал помощи от государства и от благотворителей, так как в этот период стране и государству было не до нас: сначала была пандемия КОВИДА-19, а затем началась специальная военная операция (СВО), и вся жизнь и ее приоритеты круто изменились для нас и всей нашей страны.
В результате проводимой работы нам удалось сформулировать основные фундаментальные положения новой медицинской технологии геноориентированной и протеом-основанной эпигенетической терапии (ЭТ) для лечения пациентов с БЦ с клональным гемопоэзом. Впервые целью персонализированного лечения было не столько восстановление повреждений молекулярной структуры ДНК в ГСК и ГПК, сколько использование генетического материала (двуцепочечных ДНК) для терминальной дифференцировки ГСК и повышения их способности к выживанию. Точнее, ЭТ для пациента представляла собой не генную модификацию гемопоэтических прогенеторов, сколько эпигенетическую модуляцию ГСК здоровым генетическим материалом дцДНК. Фармацевтическая эпигенетическая модуляция ГСК лекарственной субстанции «Панаген» ставила задачей вывод ГСК и МСК в терминальную дифференцировку и реставрацию эпигенетических отметок на геноме. Таких задач для терапии БЦ никто и никогда не ставил. Целью генотерапии всегда была реставрация генетического дефекта путем разрезания ДНК и встраивания туда куска другой ДНК, а не создание условий для «истощения стволовых и прогенеторных клеток и иммунокомпетентных клеток» доминирующего клона ГСК и реставрация молекулярной структуры ГСК. Мы пришли к достаточно ортодоксальному и, возможно, спорному выводу о том, что предложенная технология реституции костного мозга абсолютно безопасна для животных и человека и может, с одной стороны, стать в ряде случаев БЦ реальной заменой аутологичной и аллогенной трансплантации костного мозга (ТКМ), а также альтернативой геномному редактированию и даже эпигенетическому редактированию.
Известно, что ТКМ уже сегодня эффективна при более чем 300 болезнях человека, но имеет риск смертельных осложнений при классическом проведении ТКМ. Она крайне сложна и является финансово затратной в традиционном исполнении и имеет определенные трудности в аппаратном обеспечении и потребности в специально подготовленном персонале (наличие специалистов — врачей-гематологов и профессионально подготовленного среднего персонала, специализированные стерильные боксы, замкнутые вентиляционные потоки, умение бороться с госпитальной инфекцией, дорогостоящие зарубежные медикаменты и т. д.). Стоимость ТКМ в России по системе ОМС составляет 3 млн рублей, а в США и странах Евросоюза от $150 000 до $220 000 (17—20 млн рублей). С другой стороны, мы пришли к выводу, что предложенная нами природоподобная технология геномного балансирования хроматина ГСК как этап реституции костного мозга в структуре ГПОЭТ может стать реальной альтернативой зарубежным технологиям геномного редактирования при целом ряде наследственных орфанных заболеваний человека. При этом в последнем случае технология не использует опасных для жизни человека молекулярных ножниц типа «цинковых пальцев», CRISPR/Cas9-инструментария, не использует вирусы, векторы и плазмиды и другие носители генетического материала, которые применяются для геномного редактирования, а основана на природоподобных механизмах физиологического саногенеза в организме человека и других эукариот. Она была рождена и доработана в организмах эукариот Эволюцией, Природой или самим Богом!
Как структурирована эта монография? В предисловии к книге авторы попытались рассказать об истории написания данного научного труда и представить свою точку зрения на решение проблемы терапии фатальных болезней цивилизации, а также обосновать новую терминологию восстановления (реституции) костного мозга после его повреждения. Во вступлении авторы монографии пытаются объяснить суть проблемы и методологические подходы, которые было решено использовать для «разруливания» неразрешимых вопросов мировой медицины в области смертельных болезней цивилизации.
В первой главе книги обсуждается мировая социально-экономическая проблема болезней цивилизации и отсутствие реальных инструментов лечения данных болезней. Вторая глава книги вводит читателя в современное состояние проблемы клонального гемопоэза и дает характеристику современного состояния данной проблемы и пути ее решения. В третьей главе монографии представлены методы диагностики клонального гемопоэза. В четвертой главе клональный гемопоэз рассматривается как фундаментальная молекулярно-биологическая причина возникновения и прогрессирования нейродегенеративных болезней цивилизации и презентируется новаторский научный факт наличия клонального гемопоэза при прогрессировании нейродегенеративных болезней человека. Впервые в мире в научной литературе причиной патогенеза НДБ называется клональный гемопоэз или CHIP, который формирует активированные ИКК крови, которые приводят к нейровоспалению за счет активации глиальных клеток, астроцитов и микроглии и, как следствие, приводят к дегенерации сосудов и нейронов нервной ткани головного и спинного мозга. В пятой главе книги вниманию читателей предлагается развернутое понимание современного концепта персонализированной медицины. В шестой главе презентуется разработанная нами биотехнология генотерапии, обозначенная как биотехнология геномного балансирования хроматина ГСК. В данной главе достаточно подробно объясняется механизм генотерапевтического воздействия и реставрации поврежденных собственных ГСК пациентов с БЦ, а также формирование генотерапевтического продукта. В этой главе обсуждаются существующие научные подходы в современной персонализированной медицине в лечении различных болезней. Последующая, седьмая глава монографии представляет результаты экспериментального изучения данной технологии генотерапии в лаборатории на клеточных культурах и на моделях болезней на трансгенных животных (болезнь Альцгеймера, болезнь моторного нейрона и модель старения). В восьмой главе монографии нами представлена мотивация и обоснование предложенного научного направления реституции костного мозга (РКМ) пациентов с фатальными БЦ, сопровождающимися клональным гемопоэзом. В этой главе дается научное определение термина РКМ и дано описание его клинического содержания, а также полностью описаны стадии проведения РКМ. В девятой главе книги представлена оценка эффективности РКМ и возможные осложнения технологии. В десятой главе книги приведены клинические результаты и примеры проведения лечения с использованием РКМ при раке и других онкологических заболеваниях, при сахарном диабете 1-го типа и других аутоиммунных заболеваниях, при нейродегенеративных заболеваниях (болезнь Альцгеймера, боковой амиотрофический склероз, системная нейродегенерация коры головного мозга), а также при некоторых наследственных заболеваниях (таласемии и ряде наследственных заболеваний нервной системы). В заключении монографии мы обобщаем полученные результаты проведенных исследований и подводим итоги проделанной работы.
Глава 1. Неинфекционные болезни цивилизации как глобальная социально-экономическая проблема человечества. Роль и место персонализированной медицины в их лечении
Болезни цивилизации (БЦ) — это собирательный медицинский термин, под которым подразумеваеются большие классы различных по этиопатогенезу и клиническим проявлениям неинфекционных болезней человека, возникшие в разных странах мира за последние 150—200 лет. БЦ — это тяжелые, неуклонно прогрессирующие и зачастую смертельные неинфекционные заболевания человека, распространенные в экономически развитых странах, происхождение которых связано с неблагоприятным и нередко истрессовым воздействием на человека негативных последствий ряда достижений научно-технического прогресса и загрязнения окружающей среды, приведших к глобальным изменениям климата и экологическим катастрофам и существенно повлиявших на здоровье человеческой популяции. При этом под термином «здоровье» понимается сложное, глобальное, социокультурное и общечеловеческое явление, имеющее непреходящую ценность для человека. На сегодняшний день здоровье определяет специфику современного общества в его движении к исторически новому состоянию (Волынкина А. П., Горшков И. П., Мананникова В. И., 2015). Исходя из этих представлений о здоровье, под болезнями цивилизации большинство исследователей в настоящее время понимают заболевания человека, связанные с духовным неблагополучием, нарушением морально-нравственных норм и механизмов адаптации к неблагоприятным факторам антропогенно измененной среды в условиях стремительного роста научно-технического прогресса (Агаджанян Н. А., Чижов А. Я., Ким Т. А., 2003). Вот другое похожее определение БЦ, данное значительно позже А. П. Волынкиной, И. П. Горшковым, В. И. Мананниковой (2015): в последние десятилетия появился и постепенно закрепился термин «болезни цивилизации» (болезни XX — ХXI веков), под которым подразумеваются заболевания, возникшие в связи с развитием человеческого общества, — заболевания, связанные с духовным неблагополучием, нарушением морально-нравственных норм и механизмов адаптации к неблагоприятным факторам антропогенно измененной среды в условиях стремительного роста научно-технического прогресса, характерного для этого столетия, и рядом других проявлений человеческой деятельности, носящих глобальный характер. Решение проблемы улучшения здоровья человека, по мнению А. П. Волынкиной., И. П. Горшкова, В. И. Мананниковой (2015) возможно лишь посредством изменения самого человека, его мировоззрения. Необходимо формировать здоровье человека целостно, в единстве тела, души и духа, с соответствующей иерархией материальных и духовных ценностей.
Несмотря на всю лингвистическую красоту и объемность подобного научного понимания термина «здоровье» и путей его сохранения и восстановления, официальная международная медицина уходит от термина «болезни цивилизации». Всемирная организация здравоохранения (ВОЗ) определяет БЦ исключительно как неинфекционные заболевания (НИЗ), опуская из этических и моральных причин центральную и определяющую роль цивилизационного фактора (урбанизацию, индустриализацию, компьютеризацию, экологический дисбаланс, климатические катаклизмы, постоянные локальные военные конфликты и т. д.), в их развитии и прогрессировании. ВОЗ, называя их только неинфекционными болезнями, отрицает в развитии этих заболеваний связь с негативной деятельностью человека и его отрицательным воздействием на климат и природу планеты, а также на всю окружающую среду, экономику и социальное микроокружение как главные факторы в их возникновении и развитии. С одной стороны, это достаточно правильный и логичный подход к очерчиванию этой определенной группы болезней от большой группы инфекционных болезней, имеющих отличную этиологию и другой патогенез. Но, с другой стороны, неинфекционных болезней достаточно много (лекарственная болезнь, профессиональные болезни, морская болезнь, болезни, обусловленные хронической интоксикацией, лучевая болезнь и др.), и эти болезни не связаны с воздействием неблагоприятных факторов влияния человеческой цивилизации и требуют своей систематизации с учетом других классификационных признаков. Поэтому нам представляется более правильным и научно обоснованным называть их не НИЦ, а неинфекционные болезни цивилизации (НИБЦ), так как роль экономики и социума конкретной цивилизации в их патогенезе и динамике каждой из них является определяющей и доминирующей для их возникновения и прогрессирования. Это позволит найти единые и объединяющие эти различные нозологии патогенетические факторы возникновения и прогрессирования этих болезней. Понять, что является запускающим и поддерживающим заболевание молекулярно-биологическим механизмом этих болезней, пока не удается. К НИБЦ относятся в первую очередь болезни сердечно-сосудистой системы, являющиеся главной причиной смертности населения в мире (ишемическая болезнь сердца, атеросклероз, гипертония, инфаркты, инсульты), злокачественные онкологические заболевания (все виды раков, онкогематологические злокачественные болезни, миеломная болезнь, мультиформная глиобластома, меланомы и др.), аутоиммунные заболевания (рассеянный склероз, системная красная волчанка, полимиозит, ревматоидный артрит, аутоиммунный тиреоидит, сахарный диабет 1-го типа и др.) и все виды аллергии, нейродегенеративные болезни (боковой амиотрофический склероз, болезнь Паркинсона, болезнь Альцгеймера, все виды сосудистых и сенильных деменций и др.), дегенеративные заболевания органов и тканей опорно-двигательного аппарата (остеохондроз позвоночника, дегенерации мышц, костей и суставов), болезни нарушения обмена (ожирение, анорексия невроза, сахарный диабет 2-го типа и т. д.), наследственные заболевания, передающиеся из поколения в поколение или через поколение, обусловленные генными или хромосомными мутациями, и другие болезни. При этом БЦ, которые годами считались аутоиммунными (боковой амиотрофический склероз и рассеянный склероз), в начале этого века стали относить к нейродегенеративным. Считается, что этими болезнями на протяжении предыдущих двух тысячелетий наши предки страдали очень редко, за исключением наследственных заболеваний. А в последние два столетия нашей цивилизации НИБЦ стали главной причиной смертности населения в мире, обогнав по уровню смертности все вирусные инфекционные заболевания и заболевания, связанные с бактериальными инфекциями и патогенными микроорганизмами (сифилис, туберкулез, лепра, проказа и т. д.).
Основной причиной смерти населения в Древнем мире и в Средние века были эпидемии и даже пандемии некурабельных бактериальных и вирусных инфекций, большая смертность женщин при родах и младенческая смертность, гнойно-септические осложнения травм органов и тканей человека, психиатрические болезни. Считается, что до возникновения современных заболеваний цивилизации население Земли просто физически не доживало. Средняя продолжительность жизни в Древнем мире составляла 25—30 лет, в Средние века она увеличилась до 45—50 лет, а в XX веке средняя продолжительность жизни выросла до 60—65 лет. В XXI веке продолжительность жизни увеличилась в высокоразвитых государствах до 75—80 лет.
Причиной увеличения продолжительности жизни населения стали научные прорывы в понимании болезней и научные достижения в мировом здравоохранении. Первым таким научным прорывом стало появление микроскопа и осознание человечеством огромного микромира вирусов и бактерий, окружающих нас, что привело к внедрению асептики и антисептики в хирургию, травматологию и родовспоможение. Научный прорыв в понимании эпидемиологии инфекционных болезней и механизмов заражения инфекционными и бактериальными болезнями увеличил на 5—10 лет продолжительность жизни людей на Земле. Другой вехой увеличения продолжительности жизни человека на 10—15 лет стало изобретение вакцин и сывороток от смертоносных инфекций и поголовная вакцинация детей и взрослых, что позволило остановить эпидемии брюшного тифа, черной оспы, полиомиелита, чумы и т. д. Создание вакцины от бешенства и столбняка резко сократило смертность от этих ранее неизлечимых болезней. Еще на 10—15 лет увеличило продолжительность жизни человека на Земле эра антибиотиков. Открытие антибиотиков позволило справиться с тяжелыми фатальными острыми пневмониями и гнойно-септическими осложнениями при травмах головы и конечностей и повреждениях внутренних органов. Разработка и создание противоопухолевых препаратов, и в том числе инновационных таргетных (молекулярно нацеленных) и иммунных противоопухолевых препаратов, в конце XX века добавили к продолжительности жизни современного человека еще 15—20 лет. Очередной прорыв в увеличении продолжительности жизни современного человека возможен при понимании механизмов неинфекционных болезней цивилизации как главной причины смертности населения всего мира. Именно поэтому актуальность этих исследований имеет огромную значимость для всего человечества и может стать важной вехой открытия новой эры возможности излечения от основных НИБЦ.
Итак, статистически доказано, что в наше время социально значимые неинфекционные БЦ являются основной причиной заболеваемости, инвалидности и смертности населения экономически развитых стран, особенно среди трудоспособной части населения этих стран. Эти болезни наносят серьезный экономический ущерб этим странам в силу выбывания из производственных цепочек производителей материальных благ их самой продуктивной части молодого населения. Если трудоспособная часть населения погибает из-за болезни, то общество невосполнимо теряет важные трудовые ресурсы для своей экономики, а если эти пациенты становятся нетрудоспособными инвалидами, то общество берет на себя бремя выплаты им социальных пособий и пенсий. Сегодня к социально значимым заболеваниям относятся болезни системы кровообращения, злокачественные новообразования (ЗНО), травмы, отравления и некоторые другие последствия воздействия внешних причин, сахарный диабет, туберкулез. То есть они очень перекликаются с БЦ по нозологическим формам заболеваний, но различаются по их негативному влиянию на социум и гражданское общество. Социально обусловленные заболевания формируются под воздействием ближайшего окружения человека и связаны с социально-экономическим состоянием страны проживания. К этой группе относятся болезни наркологического профиля, венерические болезни, туберкулез, вирусный гепатит В и др.
Поскольку социально обусловленные заболевания распространены в одних и тех же группах населения, они часто ассоциируют (сочетаются) друг с другом, что усугубляет течение и затрудняет лечение каждой из них. Так, по данным ВОЗ, более 3 млн человек являются одновременно инфицированными возбудителями туберкулеза и ВИЧ. Более 90% ВИЧ-инфицированных — это наркоманы. Среди заболевших инфекциями, передающимися половым путем (ИППП), около 70% злоупотребляют алкоголем, 14% страдают хроническим алкоголизмом либо наркоманией. Если в 1991 году из 531 тыс. больных венерическими заболеваниями было выявлено 12 ВИЧ-инфицированных (2,3 на 100 тыс.), то в 1999 году из 1739,9 тыс. больных с ИППП 822 человека были с ВИЧ-инфекцией (47,2 на 100 тыс.). Смертность от болезней цивилизации не естественна для человека как для биологического вида, ее можно избежать, ведя здоровый образ жизни (ЗОЖ), поэтому она называется предотвратимой. Смертность от болезней сердечно-сосудистой системы и рака можно и нужно успешно снижать путем раннего их выявления и адекватной диагностики при профилактических осмотрах. Как раз на решение этой проблемы направлена диспансеризация трудоспособного населения России, проводимая в рамках Национального проекта «Здоровье». Предотвращение смертности от алкоголизма и наркомании должно происходить через профилактику поведенческих факторов риска путем формирования здорового образа жизни (ЗОЖ) у населения, а особенно у детей и подростков, разработку мер антиалкогольной политики. Таким образом, при ведении ЗОЖ современный человек имеет все возможности избежать вышеперечисленных заболеваний и оставаться здоровым и активным на долгие годы (https://medbe.ru/health/polezno-dlya-zdorovya/bolezni-tsivilizatsii-problema-sov-remennogo-cheloveka/, Шурыгина Ю. Ю., 2017).
По мнению Всемирной организации здравоохранения (ВОЗ), основные факты, связанные с ГИБЦ, можно представить следующими цифрами (https://www.who.int/ru/news-room/fact-sheets/detail/noncommunicable-diseases):
• Каждый год от НИБЦ умирает 41 млн человек, что составляет 74% всех случаев смерти в мире.
• Каждый год от НИБЦ умирает 17 млн человек в возрасте до 70 лет; 86% этих преждевременных случаев смерти приходится на долю стран с низким и средним уровнем дохода.
• В странах с низким и средним уровнем дохода происходит 77% всех случаев смерти от НИБЦ.
• В структуре смертности от НИБЦ наибольшая доля приходится на сердечно-сосудистые заболевания, от которых каждый год умирает 17,9 млн человек и за которыми следуют раковые заболевания (9,3 млн случаев), хронические респираторные заболевания (4,1 млн случаев) и диабет (2 млн случаев, включая обусловленные диабетом заболевания почек).
• Эти четыре группы заболеваний вызывают 80% всех случаев преждевременной смерти от НИБЦ.
• Риск смерти от НИБЦ повышают такие факторы, как употребление табака, низкий уровень физической активности, злоупотребление алкоголем и нездоровое питание.
• Основные направления борьбы с НИБЦ включают выявление, скрининг и лечение НИБЦ, а также оказание паллиативной помощи.
НИБЦ, которые также называют хроническими заболеваниями, как правило, имеют продолжительное течение и развиваются в результате совокупного воздействия генетических, физиологических, экологических и поведенческих факторов. К основным типам НИБЦ относятся сердечно-сосудистые заболевания (такие, как инфаркт и инсульт), раковые заболевания, хронические респираторные заболевания (такие, как хроническая обструктивная болезнь легких и астма) и диабет. Бремя НИБЦ диспропорционально велико в странах с низким и средним уровнем дохода, в которых происходит более трех четвертей случаев смерти от НИБЦ во всем мире (31,4 млн случаев).
Существует множество теорий обусловленности здоровья человека. Одной из самых распространенных среди них является именно теория болезней цивилизации и социальной дезадаптации. Эту теорию представили еще в 50-х годах XX века французские медики Э. Гюан и А. Дюссер в книге «Болезни нашего общества». Эта теория представляет собой ответ на вопрос о причинах резких изменений общественного здоровья, особенно сокращения его потенциала и возникновения массовой патологии. Патология (от греч. Раthos + logia — переживание, страдание, болезнь + учение, наука) — болезненное проявление, не норма для организма. Б. Н. Чумаков (2001) иллюстрирует понятие «болезни цивилизации» следующими фактами. Интересен результат вскрытия более 300 погибших солдат американской армии во время корейских событий в 50-е годы, возраст которых равнялся 22 годам, не имевших признаков атеросклероза. При жизни они считались абсолютно здоровыми. При патологоанатомическом вскрытии у 75% из них были поражены коронарные сосуды атеросклеротическими бляшками. У каждого четвертого просвет артерий оказался суженным на 20%, а у каждого десятого — на 50%. Такую картину можно наблюдать у жителей стран с высоким жизненно-экономическим потенциалом. А вот как выглядит ситуация в менее цивилизованных странах. Итальянский врач Липичирелла при обследовании 203 погонщиков верблюдов в 1962 году в Сомали не обнаружил ни у одного из них признаков атеросклероза. При вскрытии 6 500 умерших местных жителей в Уганде не было выявлено ни одного случая коронарного атеросклероза или инфаркта миокарда. При обследовании 776 негров в Западной Африке с помощью ЭКГ лишь в 0,7% случаев наблюдались незначительные отклонения со стороны сердечно-сосудистой системы. Г. Л. Апанасенко считает, что развитие многих соматических заболеваний связано с негативным воздействием некоторых социально-гигиенических факторов. Так, у людей в возрасте 35—64 лет риск развития ишемической болезни сердца (ИБС) увеличивается при ожирении в 3,4 раза, при гиподинамии — в 4,4, при высоком уровне холестерина крови — в 5,5 раза, при повышенном уровне артериального давления — в 6 раз, а при курении — в 6,5 раза. При объединении нескольких неблагоприятных социально-гигиенических факторов вероятность развития заболевания увеличивается в разы. Лица, у которых отсутствуют признаки заболеваний, но выявлены перечисленные факторы риска, формально относятся к группе здоровых, но у них возможность развития ИБС в ближайшие 5—10 лет весьма вероятна. Факторы риска — общее название факторов внешней и внутренней среды организма, поведенческих привычек, не являющихся непосредственной причиной определенной болезни, но способствующих увеличению вероятности ее возникновения и развития, ее прогрессированию и неблагоприятному исходу.
Заболевания цивилизации человека связывают с результатом развития индустриального общества — «экономикой дымных труб», информатизацией, социальными изменениями, радиационной ситуацией на планете, лечением лекарственными препаратами, а также с порочными наклонностями. Это основная причина ухудшения здоровья населения всей планеты. Первопричина всех болезней цивилизации лежит в дисбалансе отношений человека с природой. Болезни цивилизации угрожают основам жизни людей во всем мире и ведут к самоуничтожению человечества!
НИБЦ распространены во всех возрастных группах, всех регионах и всех странах. Эти заболевания часто связывают с пожилыми возрастными группами, но, как мы ранее подчеркивали, фактические данные свидетельствуют о том, что 17 млн случаев смерти от НИБЦ происходят среди лиц младше 70 лет. При этом 86% таких случаев преждевременной смерти имеет место в странах с низким и средним уровнем дохода. Способствующие развитию НИБЦ факторы риска (нездоровое питание, недостаточная физическая активность, воздействие табачного дыма или злоупотребление алкоголем) угрожают всем возрастным группам — детям, взрослым и пожилым.
Развитию этих заболеваний способствуют такие факторы, как быстрая и неупорядоченная урбанизация, глобальное распространение нездорового образа жизни и старение населения. Последствия нездорового питания и недостаточной физической активности могут проявляться в виде повышенного артериального давления, повышенного содержания глюкозы в крови, повышенного уровня липидов в крови и ожирения. Это так называемые метаболические факторы риска, которые могут приводить к развитию сердечно-сосудистых заболеваний — ведущей причины смертности от НИБЦ.
Что же заставляет выделять эти заболевания в отдельную группу? С начала XX столетия уровень заболеваемости БЦ стал расти в геометрической прогрессии. Сегодня мы очень много знаем об этих болезнях цивилизации, но абсолютно не можем их своевременно диагностировать, а тем более эффективно лечить и профилактировать данные заболевания!
Среди бесспорных факторов риска БЦ наиболее существенными и распространенными являются следующие: гипокинезия и гиподинамия; переедание и связанная с ним избыточная масса тела; постоянное психоэмоциональное напряжение, неумение отключаться и правильно отдыхать; злоупотребление алкоголем и табакокурение. Гипокинезия (от греч. hypokinesia — недостаточность движения) — ограничение количества и объема движений, обусловленное образом жизни, особенностями профессиональной деятельности, постельным режимом в период заболевания и сопровождающееся в ряде случаев гиподинамией. Гиподинамия (от греч. hypodynamia — недостаточность силы) — уменьшение мышечных усилий, затрачиваемых на удержание позы, перемещение тела в пространстве, физическую работу. Она возникает при иммобилизации, пребывании в замкнутых помещениях малого объема, малоподвижном образе жизни. Эти две категории характеризуют малоподвижный образ жизни современного человека, связанный с вхождением в нее водопровода и централизованного отопления, широкого использования автомобилей, стиральных и посудомоечных машин и электрических плит и т. д. Все эти механизмы облегчают наш быт, делают жизнь приятной и беззаботной, с одной стороны, а с другой — приводят наши мышцы и сосуды в дряхлое состояние. В одной из популярных статей Интернета нам показались очень интересными соображения обычных журналистов о переедании современного человека — и что в этом виноват его непомерно большой, доставшийся от диких предков желудок. «Вспомните, как добывал себе пищу первобытный человек. Сначала он без экскаватора и даже без лопаты должен был выкопать целый котлован. Потом с диким криком бегать, устрашать и загонять туда мамонта. А какого размера булыжник должен был быть, чтобы этого мамонта им убить? А как потом снять с него шкуру без ножа? А вытащить из котлована без подъемного крана? И тут только начинался момент поедания пищи. А вокруг гиены и грифы, которые уже ждали остатков от пиршества человека. Про запас пищу некуда было девать — холодильников и морозильных камер не существовало. Так длилось миллионы лет, и выживал только тот, у кого желудок был больше, кто мог одномоментно набить туда большое количество пищи, ведь новый случай отобедать мясом мамонта мог представиться только через 1—2 недели. Современный человек добывает пищу легким движением руки, открывая дверь бытового холодильника несколько раз в день или 2—3 раза в день, посещая учреждения общепита. Его желудок при приеме больших ее количеств не растягивается, как воздушный шар, а просто набивается до предела».
Как мы видим из представленного описания, постоянное переедание приводило к увеличению массы тела — ожирению, а ожирение — к болезням сердечно-сосудистой системы. Кроме того, современный человек ушел от гармонии с природой, он уже не ложится спать с заходом солнца и не просыпается, когда его первые лучи проникают в пещеру, и т. д. Пробуждение от звонка будильника уже не физиологично и вызывает стресс, и так целый день на протяжении многих лет. А неуверенность в завтрашнем дне, бесконечные революции, войны, пандемии инфекционных и вирусных заболеваний, перестройки и экономические кризисы? Все это привело к тому, что современный человек, по мнению ученых, находится в состоянии хронического стресса, и горе тому, кто не умеет с этим стрессом бороться. Из всего вышеперечисленного можно сделать вывод, что болезни цивилизации, к которым относятся в первую очередь болезни сердца и сосудов, онкологические и аллергические, аутоиммунные болезни, формируются из-за невозможности человеческого организма адаптироваться к стремительным изменениям окружающей среды, нарушениям ритма и образа жизни, которые происходят под воздействием техногенной модернизации условий жизни, достижений научно-технического прогресса, развития цивилизации.
Прогнозы увеличения некоторых фатальных заболеваний цивилизации на ближайшие 20—30 лет выглядят очень пессимистичными и удручающими.
Сердечно-сосудистые заболевания: по данным Всемирной организации здравоохранения (https://news.un.org/ru/story/2017/09/1311861), сердечно-сосудистые заболевания, такие как гипертония, ишемическая болезнь сердца, нарушения мозгового кровообращения, сердечная недостаточность и пороки сердца, являются главной причиной смерти в мире и ежегодно уносят миллионы жизней. По прогнозам, в 2030 году от этих болезней умрет 23,5 млн человек. В Европейском регионе сердечно-сосудистые заболевания — причина половины всех смертей. 80% сердечно-сосудистых заболеваний регистрируют в странах с низким и средним уровнем дохода.
Рак и другие злокачественные новообразования (ЗНО): в настоящее время в мире раковых больных 15,12 млн человек. Согласно последнему отчету ВОЗ, к 2030 году количество новых случаев заболевания раком возрастет примерно на 70%, достигнув цифры 21,6 млн больных в год (http//worldofoncology.com/materialy/o-rake/statistika/). Считается, что в 2050 году их количество достигнет почти 40 млн человек (Каприн А. Н., 2020).
Нейродегенеративные болезни (НДБ): резкое постарение населения в США и Европе привело к увеличению количества больных со слабоумием и болезнью Альцгеймера, число которых может вскоре утроиться — с 4,7 млн в 2012 году до 13,8 млн к 2050 году. К 2050 году каждый из 85 человек во всем мире будет страдать болезнью Альцгеймера (Институт здорового старения, США, 2012). Каждый третий житель земли страдает нервно-психическими заболеваниями. В геометрической прогрессии нарастает количество людей с тяжелыми органическими заболеваниями мозга, в арифметической прогрессии растет количество самоубийств и социопатов с расстройствами личности. Успехи современной нейрореанимации и нейрохирургии привели к увеличению в мире количества глубоких инвалидов, находящихся в вегетативном состоянии и с массивными поражениями мозговой ткани и интеллектуальным дефектом.
Аутоиммунные заболевания (АИЗ): аналогичная ситуация сложилась с целым рядом АИЗ. Количество больных с системной красной волчанкой (СКВ), ревматоидным артритом (РА), рассеянным склерозом (РС) и другими аутоиммунными заболеваниями вырастет за ближайшие 20 лет на 37%, а количество больных с аутоиммунным сахарным диабетом превысит полмиллиарда человек в 2040 году (Отчет ВОЗ, 2019). Смертность от этих тяжелых заболеваний цивилизации продолжает неуклонно возрастать, и противопоставить этим фактам просто нечего. Поэтому поиск любого способа лечения и терапевтического средства, способного хотя бы незначительно повысить эффективность терапии этих фатальных заболеваний цивилизации и снизить смертность от них, приобретает крайнюю актуальность и значимость для всей мировой медицины.
Наследственные болезни: в настоящее время известны около 7 000 орфанных (редких) наследственных болезней, из которых более 1 500 заболеваний составляют наследственные нервные болезни (65 млн человек). Первая проблема, с которой сталкивается пациент с редким наследственным заболеванием, — понять, что оно у него есть. C момента возникновения первых симптомов до получения диагноза (англ. — diagnostic delay) в среднем проходит 5—7 лет. Все это время люди с редкими заболеваниями долго скитаются по разным врачам и часто вынуждены проходить многочисленные диагностические тесты до установления точного диагноза. Подобного рода скитания даже получили название «диагностической одиссеи». В половине случаев такие пациенты посещают не менее пяти врачей и получают по меньшей мере один неправильный диагноз. В среднем люди с редкими заболеваниями получают три неправильных диагноза, что может вести за собой неправильно подобранное лечение и вообще закончиться смертельным исходом. Каждая клетка организма больного с наследственными болезнями нервной системы имеет один или несколько наследуемых хромосомных или генетических дефектов (мутаций) собственного генома, но человек (если он не умер в детстве) может дожить с этим заболеванием до взрослого состояния и даже до старости, не подозревая об этих фундаментальных молекулярно-биологических изменениях собственных ДНК генома («стабильность и устойчивость» генома), а возникновение у него болезни может проявиться как гром среди ясного неба, без видимых причин! Каждый член семьи больного с наследственными болезнями нервной системы, как правило, знает о наличии у него одного или нескольких наследуемых семейных генетических дефектов (мутаций) собственного генома, но несмотря на эти знания он может прожить всю свою жизнь, даже до старости, и его заболевание не манифестирует, но болезнь (декомпенсация и прогрессирование состояния) может дебютировать в любое время.
Наиболее часто люди узнают о своем наследственном заболевании нервной системы, когда у них рождаются свои больные дети с генетическими, врожденными и наследуемыми заболеваниями или родители были генетически здоровы, но в период гестации (вынашивания) у плода развились мутации вследствие интоксикации (лекарственные препараты, прием родителями алкоголя и наркотиков, облучение ионизирующей радиацией, психогении или стресс в период беременности и др.), и ребенок родился с наследственной болезнью.
С чем связано такое неуклонное увеличение количества НИБЦ? Существует ряд объективных обстоятельств, в связи с которыми БЦ стали одной из главных причин смертности населения в мире. Их можно определить следующим образом:
1. Причины и патогенез возникновения большинства фатальных болезней цивилизации (БЦ) окончательно не ясны.
2. Существует проблема поздней диагностики фатальных заболеваний цивилизации: не обнаружено объективных клинических, морфологических, биофизических, иммунохимических, генетических и постгеномных молекулярно-биологических маркеров этих смертельных болезней, и при большинстве заболеваний отсутствует в принципе ранняя диагностика этих болезней.
3. Заболевания текут асимптомно, и их диагностируют только тогда, когда большая часть специализированных дифференцированных клеток организма человека уже погибла и не может быть восстановлена. Например, при боковом амиотрофическом склерозе (БАС) заболевание диагностируют клинически и нейрофизиологически только тогда, когда погибло более 70—80% мотонейронов головного и спинного мозга человека, а при большинстве онкологических заболеваний клинические проявления болезни появляются на 3—4-й стадии неопластического процесса и, как правило, при генерализованном процессе и наличии большого количества метастазов в органах и тканях.
4. Существующее лечение не эффективно и практически не изменяет медиану выживаемости больных, например: при мультиформной глиобластоме, несмотря на все виды современного лечения, медиана выживаемости составляет 12—15 месяцев последние 100 лет. При БАС медиана выживаемости 24—36 месяцев и т. д. Средняя продолжительность жизни при диагностике рака поджелудочной железы составляет 6—8 месяцев, несмотря на все виды противоопухолевого лечения.
Что сегодня нам известно о НИБЦ и что их все объединяет? С возрастом в тканях человека накапливается все больше соматических мутаций. В то время как большинство этих мутаций имеют незначительные функциональные последствия или вообще не имеют их (мутации — пассажиры), может возникнуть мутация, которая дает преимущество приспособленности к клетке. Когда этот процесс происходит в кроветворной системе, значительная часть циркулирующих клеток крови может происходить из одной мутировавшей кроветворной стволовой клетки. Этот процесс, называемый «клональным кроветворением», прогрессирует по мере увеличения возраста человека. По мере роста доказательной базы, с одной стороны, растет уверенность в том, что клональный гемопоэз является частным случаем старения организма и его изучение позволяет заглянуть в процесс мутации и отбора, который происходит во всех соматических тканях (Jaiswal S., 2020). С другой стороны, клональный гемопоэз — это главный системообразующий молекулярно-биологический механизм возникновения и прогрессирования большинства НИБЦ, и мы это покажем в данной монографии.
Одни из наиболее распространенных типов мутаций связаны с появлением небольших вставок и делеций, которые обычно возникают из-за ошибок, возникающих при негомологичном соединении концов двухцепочечных разрывов ДНК, и могут приводить к мутациям со сдвигом рамки считывания, если разрывы происходят в кодирующих белок участках генома. Количество циклов репликации, которым подвергается клетка, обычно увеличивается с возрастом; поэтому количество ошибок полимеразы также кумулятивно увеличивается.
Таким образом, понятие «фатальные БЦ» — это уже состоявшийся научный факт и это социальный бич нашей цивилизации и особенно наших городов и крупных мегаполисов. Именно они стали основной причиной смертности населения планеты в конце XX и начале XXI века. Понимание фундаментальных причин возникновения этих смертельных неинфекционных заболеваний должно стать базовой основой выживания всего человечества. Эти болезни забрали пальму первенства причин смерти у инфекционных заболеваний, эпидемии которых косили население планеты в прошлых веках. По-видимому, после того как мы научимся диагностировать БЦ на раннем этапе и успешно их лечить, придут следующие заболевания, характерные для второго столетия жизни человека, которые станут вызовом для медицинского сообщества нашей Земли уже в середине этого века. Ну, а пока это произойдет, исследователи должны попытаться понять системные механизмы патогенеза болезней цивилизации и заняться их системообразующими факторами возникновения и развития и, самое главное, решить проблему лечения этих пока неизлечимых болезней человечества.
НИБЦ угрожают сорвать темпы осуществления повестки дня ВОЗ в области развития на период до 2030 года, которая включает задачу по сокращению на треть вероятности смерти лиц в возрасте от 30 до 70 лет от любого из четырех типов НИБЦ к 2030 году. Существует тесная связь между бедностью и НИБЦ. По прогнозам, стремительный рост заболеваемости НИБЦ, вызывающий рост расходов домохозяйств на медицинскую помощь, будет ограничивать эффективность инициатив по сокращению масштабов бедности в странах с низким уровнем дохода. Представители уязвимых и незащищенных категорий населения по сравнению с представителями более благополучных социальных групп чаще болеют и умирают в более молодом возрасте главным образом потому, что они подвергаются повышенному риску употребления вредной для здоровья продукции, в частности табачных изделий и нездоровых продуктов питания, и имеют ограниченный доступ к медицинским услугам.
В условиях низкой обеспеченности ресурсами расходы на медицинскую помощь при НИБЦ приводят к быстрому истощению ресурсов домохозяйств. Каждый год непомерные издержки, связанные с НИБЦ, в том числе расходы на лечение, которое нередко бывает продолжительным и дорогостоящим, в сочетании с утратой дохода ввергают людей в нищету и препятствуют процессу развития.
Важным направлением борьбы с НИБЦ является целенаправленное уменьшение факторов риска, способствующих развитию этих заболеваний. В распоряжении правительств и других заинтересованных сторон имеются недорогостоящие решения, позволяющие ослабить наиболее распространенные и поддающиеся воздействию факторы. При выработке мер политики и определении приоритетных задач важно отслеживать ход работы, тенденции заболеваемости НИБЦ и динамику соответствующих рисков. Для снижения ущерба, наносимого НИБЦ человеку и обществу, требуется комплексный подход с участием всех секторов, включая здравоохранение, финансы, транспорт, образование, сельское хозяйство, планирование и другие, которые должны работать друг с другом для сокращения рисков развития НИБЦ и содействовать осуществлению мероприятий по их профилактике и лечению.
Важнейшее значение имеет выделение ресурсов на повышение качества мероприятий по борьбе с НИБЦ. Эти мероприятия включают выявление, скрининг и лечение таких болезней и предоставление доступа к паллиативной помощи для всех нуждающихся. Для более своевременного выявления и лечения НИБЦ такие базовые мероприятия могут с высокой эффективностью проводиться учреждениями первичной медико-санитарной помощи. Согласно имеющимся данным, эти мероприятия при условии их своевременного проведения приносят существенную экономическую отдачу, поскольку сокращают потребности в более дорогостоящем лечении. Страны, население которых недостаточно охвачено медицинским обслуживанием, вряд ли могут обеспечить повсеместную доступность базовых мероприятий по профилактике и лечению НИБЦ. Их проведение является условием выполнения задачи по борьбе с НИБЦ в рамках целей в области устойчивого развития (ЦУР).
В повестке дня деятельности ВОЗ в области устойчивого развития на период до 2030 года НИБЦ признаются одним из главных препятствий для устойчивого развития. В рамках повестки дня главы государств и правительств обязались провести масштабную работу на национальном уровне, с тем чтобы к 2030 году уменьшить на треть преждевременную смертность от неинфекционных заболеваний посредством профилактики и лечения (задача 3.4 ЦУР). ВОЗ играет ключевую, руководящую роль в координации и поддержке глобальных усилий по борьбе с НИБЦ и выполнении задачи 3.4 в рамках целей в области устойчивого развития. В 2019 году Всемирная ассамблея здравоохранения продлила действие Глобального плана действий по профилактике НИБЦ и борьбе с ними до 2030 года и для ускорения прогресса в области профилактики НИБЦ и борьбы с ними призвала разработать дорожную карту осуществления Плана на 2023—2030 годы. Дорожная карта способствует принятию мер по достижению комплекса из девяти глобальных целей, позволяющих внести максимальный вклад в профилактику и лечение НИБЦ.
Мировым трендом в развитии современного здравоохранения и основной надеждой человечества на создание технологий излечения от болезней цивилизации является персонализированная медицина. Термин «персонализированная медицина» и его тонкие вариации, такие как прецизионная медицина или стратифицированная медицина, сегодня обычно описывают подход к медицине, который объединяет индивидуальные характеристики для ранней диагностики заболевания, прогноза, оптимального выбора лечения, точной оценки риска заболевания и целенаправленного лечения и профилактики. Главные рыночные тренды в области персонализированной медицины на Западе были сформулированы Международным консорциумом персонализированной медицины (ICPerMed) в 2018 году, и данный консорциум предоставил Еврокомиссии основной руководящий документ «Как персонализированные подходы могут проложить путь к медицине следующего поколения». В этом документе представлено видение Международного консорциума персонализированной медицины (ICPerMed) по исследованиям и внедрению персонализированной медицины (ПМ) для лечения основных неинфекционных болезней цивилизации к 2030 году в странах Евросоюза, Великобритании и США. Поскольку ICPerMed объединяет более 40 европейских и международных учреждений, целью которых является демонстрация большого экономического потенциала персонализированной медицины для улучшения и оптимизации укрепления здоровья, профилактики и лечения заболеваний, то ближайшие задачи в этой области ICPerMed видит в переводе результатов текущих научных и теоретических исследований в клиническую практику европейских врачей, содействии их внедрению в системы здравоохранения, а также в разработке моделей расчета затрат и возмещения расходов. Официально созданная в 2016 году, ICPerMed опирается на предыдущие инициативы, которые позволили выявить основные проблемы в области мировой персонализированной медицины. Опираясь на определение Horizon 2020 и выводы Европейского совета по правам человека для пациентов и охватывая всю цепочку создания стоимости в здравоохранении, ICPerMed разработала «План действий по проведению практических исследований и мероприятий по поддержке персонализированной медицины» и будет направлять стратегические обсуждения спонсоров исследований в здравоохранение в Европе и во всем мире, а также осуществлять совместные усилия его членов и Европейской комиссии по внедрению технологий персонализированной медицины в системы здравоохранения развитых государств в мировые практики. При финансовой поддержке Европейской комиссии (ЕК) ICPerMed превратилась в семейство консорциумов, программ и действий. Семейство ICPerMed вместе со связанными и родственными инициативами теперь играет очень важную роль в поддержке исследований и внедрении персонализированной медицины в Европе и за ее пределами. В будущем ICPerMed продолжил поддерживать такие инициативы и мероприятия в тесном сотрудничестве с ЕС и будет играть ведущую роль в реализации концепции персонализированной медицины в 2030 году. Общая цель состоит в том, чтобы проложить путь для следующего поколения медицины.
ICPerMed считает, что более глубокое понимание биологических факторов, факторов образа жизни и окружающей среды, которые регулируют возникновение и прогрессирование заболевания, является движущей силой для внедрения персонализированной медицины, и поэтому стремится координировать и поощрять совместные усилия в исследованиях и внедрении. В этом контексте ICPerMed разработала видение того, как использование подходов персонализированной медицины будет способствовать развитию медицины следующего поколения в 2030 году, в большей степени ориентированной на личные характеристики человека, что приведет к повышению ее эффективности. Европейская комиссия пытается: 1. Сделать членов ICPerMed мировыми лидерами в исследованиях персонализированной медицины. 2. Поддерживать научную базу персонализированной медицины посредством скоординированного подхода к исследованиям. 3. Поддерживать исследования для изучения потенциальных преимуществ персонализированных подходов к медицине для граждан и систем здравоохранения. 4. Проложить в первую очередь путь к персонализированным подходам к медицине для граждан Евросоюза.
ICPerMed определил это видение, консультируясь с европейскими и международными экспертами, охватывающими весь спектр соответствующих секторов и профессиональных знаний. Опрошенным экспертам и заинтересованным сторонам была представлена структура пяти основных аспектов управления проектами лечения болезней цивилизации: 1) грамотность граждан и расширение прав и возможностей; 2) образование, наращивание потенциала и вовлечение поставщиков персонализированных медицинских услуг; 3) оптимизированное использование и равный доступ к системе здравоохранения всех граждан; 4) безопасное управление данными и их использование и 5) понимание экономической и социальной ценности и новых бизнес-моделей персонализированной медицины для борьбы и профилактики с БЦ.
Комментарии экспертов относительно возможностей и проблем помогли уточнить общее видение, которое в дальнейшем было сформировано результатами и выводами конференции ICPerMed «Персонализированная медицина в действии» в марте 2023 года. Эксперты в целом согласились с пятью предложенными основными точками зрения ICPerMed, подчеркнув при этом некоторые конкретные проблемы, а также предложив решения. Это помогло определить сквозные аспекты, определяющие важнейшие столпы концепции управления проектами (УП) в 2030 году: данные и технологии, межсекторальное взаимодействие, реформы систем здравоохранения, образование и грамотность. Конференция «Персонализированная медицина в действии», состоявшаяся в Берлине в ноябре 2022 года, представила ряд примеров передовой практики, стратегий и других текущих мероприятий в Европе и за ее пределами, иллюстрирующих важные и многообещающие разработки для продвижения вперед в области персонализированной медицины. ICPerMed будет опираться на этот опыт в будущей деятельности. Перспективы персонализированной медицины в лечении болезней цивилизации к 2030 году, по мнению ICPerMed, представляются следующими:
Перспектива 1. Информированные, наделенные полномочиями, заинтересованные и ответственные граждане: а) все данные, связанные со здоровьем, контролируются лично гражданином; б) ввод данных о здоровье и доступ к ним поддерживаются и контролируются лично гражданином; c) имеются легкодоступные, надежные и понятные источники медицинской информации, то есть проверенные и утвержденные приложения или интернет-инструменты.
Перспектива 2. Информированные, наделенные полномочиями, заинтересованные и ответственные поставщики персонализированных медицинских услуг: а) безопасные технологии лечения для каждого пациента, поддерживаемые подходящими решениями в области информационных и коммуникационных технологий (ИКТ), станут обычным делом в клинике; b) индивидуальное лечение пациентов с множественными заболеваниями, не ответивших на лечение, пожилых людей и других уязвимых групп с минимизацией побочных эффектов будет являться рутинным, требующим принятия клинических решений междисциплинарными командами и разработки новых медицинских профессий для поддержки персонализированного здравоохранения; c) в обучении медицинских работников будут учитываться междисциплинарные аспекты персонализированной медицины, такие как использование ИКТ и вопросы политики/регулирования, включая равенство и этику, для доступа и адекватного использования всей информации. г) Клиницисты и исследователи будут тесно сотрудничать для поддержки быстрой разработки и внедрения персонализированных клинических решений.
Перспектива 3. Системы здравоохранения, обеспечивающие персонализированные и оптимизированные меры по укреплению здоровья, профилактике, диагностике и лечению на благо граждан и пациентов, обеспечат страховое покрытие, и это станет реальностью: a) gерсонализированные медицинские услуги будут оптимизированы с точки зрения эффективности и справедливости; b) справедливое и разумное распределение ресурсов в рамках систем здравоохранения будет соответствовать общественным ценностям; c) будет обеспечен безопасный поток данных о здоровье и связанных с ним сведений от граждан и систем здравоохранения к регулирующим органам и исследователям в том числе.
Перспектива 4. Доступность и оптимальное использование информации, связанной со здоровьем, для оптимизации лечения, ухода, профилактики и исследований станет нормой. a) электронные медицинские карты (EHR) будут использоваться поставщиками медицинских услуг и исследователями для более эффективного здравоохранения; b) гармонизированные решения для обеспечения конфиденциальности, безопасности и защиты данных будут использоваться прозрачным образом на протяжении всего процесса управления медицинскими данными; c) оптимизированное лечение и профилактика приносят пользу гражданам при минимальных затратах и рисках.
Перспектива 5. Экономическая ценность здравоохранения будет обеспечена за счет создания медицины следующего поколения: а) разумный баланс между инвестициями, прибылью и общей выгодой для граждан станет реальностью персональной медицины; б) будут внедрены инновационные и соответствующие бизнес-концепции и модели для управления проектами; c) решения для телемедицины и мобильные приложения будут способствовать управлению проектами и иметь экономическую ценность; d) будут создаваться новые рабочие места в системах здравоохранения, включая профессии, связанные с данными, такие как «Информационные специалисты».
Но так видят решение проблемы борьбы с неинфекционными болезнями цивилизации ведущие западные специалисты! А что в Российской Федерации с этой проблемой? Проведенный анализ ситуации в стране в области состояния, развития и продвижения предиктивной, превентивной и персонализированной медицины показал, что в настоящее время наша страна катастрофически отстает от большинства экономически высокоразвитых стран Евросоюза, Великобритании, США, Японии, Южной Кореи и Китая, где этому направлению национального здравоохранения отдан основной приоритет в экономическом развитии государства и обеспечен приоритет государственного финансирования. В нашей стране вообще не существует специализированного отечественного оборудования для полногеномных, транскриптомных, протеомных и метоболомных исследований клеток и тканей животных и человека, что является уже не проблемой медицины, а проблемой национальной безопасности страны. Все реактивы для генетических, транскриптомных, метаболомных, протеомных исследований производятся за рубежом. Клеточные коллекции, международные банки данных клеток и тканей, банки данных опухолевых клеток являются зарубежными, и российским ученым к ним ограничен или запрещен допуск. Российская наука технологически отстает от производителей продуктов, товаров и услуг ведущих стран мира почти на два десятилетия и является не производителями высоких технологий научного развития, а лишь потребителями и покупателями высокотехнологичной зарубежной продукции и товаров специализированной медицины. Еще в 2000 году бывший президент США Барак Обама, подводя итоги глобального проекта «Геном человека», объявил, что еще ни один из проектов государства (США) не был так прибылен, как данный проект персонализированной геномной медицины, и каждый доллар США, вложенный в этот проект, принес прибыль в 100 долларов. Он отметил, что такой прибыли не получают даже колумбийские наркокартели и торговцы оружием и это направление в экономике страны надо активно развивать и поддерживать. Финансовые аналитики всего мира пришли к парадоксальному заключению, что именно персонализированная медицина в экономике любой высокоразвитой страны способна конкурировать по прибыльности с доходностью нефтегазового сектора экономики и современной фармацевтической индустрией. Последним примером может служить регистрация в управлении по контролю качества пищевых продуктов и лекарственных средств (FDA) США генотерапевтического клеточного препарата «Спинраза», себестоимость которого обходится производителю (швейцарская фармкомпания «Новартис») не более 10 000 евро при его отпускной цене пациенту (Российскому государству) в 1,5—1,7 млн долларов США. Производители объясняют столь высокую стоимость цены отпускной продукции расходами, связанными с поисковыми генно-инженерными исследованиями, что на самом деле не соответствует действительности и представляет собой обычный маркетинговый ход.
К сожалению, в Российской Федерации не существует национального рынка продуктов и услуг предиктивной, превентивной и персонализированной медицины. Приказом Министерства здравоохранения РФ от 24 апреля 2018 года №186 «Об утверждении Концепции предиктивной, превентивной и персонализированной медицины» была презентирована концепция инновационного развития нашей страны в данном направлении и сообщено, что она согласована с основными положениями Стратегии научно-технологического развития Российской Федерации, утвержденной Указом Президента Российской Федерации от 1 декабря 2016 года №642 «О Стратегии научно-технологического развития Российской Федерации», государственной программы Российской Федерации «Развитие здравоохранения», утвержденной постановлением Правительства Российской Федерации от 26 декабря 2017 года №1640 «Об утверждении государственной программы Российской Федерации „Развитие здравоохранения“ и государственной программы Российской Федерации „Развитие фармацевтической и медицинской промышленности“ на 2013—2020 годы», утвержденной постановлением Правительства Российской Федерации от 15 апреля 2014 года №305 «Об утверждении государственной программы Российской Федерации „Развитие фармацевтической и медицинской промышленности“ на 2013—2020 годы», Стратегии развития медицинской науки в Российской Федерации на период до 2025 года, утвержденной распоряжением Правительства Российской Федерации от 28 декабря 2012 года №2580-р. Другими словами, Приказ Министерства здравоохранения России от 24 апреля 2018 года №186 официально легитимизировал работу в области предиктивной, превентивной и персонализированной медицины. Более того, в данном концептуальном руководящем документе Минздрава еще раз подчеркивается, что в Российской Федерации применение индивидуальных клеточных продуктов для персонализированной медицины, классифицируемых как аутологичные БМКП, регулируется Федеральным законом от 23 июня 2017 года №180-ФЗ «О биомедицинских клеточных продуктах», а обращение генотерапевтических лекарственных препаратов регулируется Федеральным законом от 12 апреля 2010 года №61-ФЗ «Об обращении лекарственных средств», что создает необходимую законодательную базу для обращения таких продуктов (препаратов) и условия для развития персонализированной медицины в части применения индивидуализированных продуктов для лечения заболеваний и коррекции состояний.
За пять лет реального существования данной Концепции предиктивной, превентивной и персонализированной медицины, утвержденной Минздравом России от 24 апреля 2018 года №186, за восемь лет действия Федерального закона от 23 июня 2017 года №180-ФЗ и более тринадцати лет наличия Федерального закона от 12 апреля 2010 года №61-ФЗ существенного прогресса в этой архиважной отрасли российского здравоохранения так и не получено. Наличие всех необходимых руководящих документов не позволило осуществиться технологическому прорыву в отечественной медицине. Так, в стране с 2016 года не зарегистрировано и не произведено ни одного БМКП и высокотехнологичного лекарственного средства для персонализированной медицины. К. А. Кошечкиным с соавт. (2021) была изучена доступность генотерапевтических препаратов в Российской Федерации на основании сведений о разрешении медицинского применения лекарственных средств этой группы. Были использованы данные литературных источников и сведения об этих препаратах, одобренных FDA, EMA и Минздравом России. В целом FDA было зарегистрировано 13 препаратов, или 46% от общего числа одобренных для медицинского применения в мире, два из них уже отозваны с рынка, а по двум проводятся дополнительные клинические исследования. В Европе EMA были одобрены для медицинского применения 16 препаратов (57%), четыре из них уже отозваны. Большинство препаратов сначала проходили одобрение FDA, а затем, в среднем через год, были разрешены на рынке Европы. Всего четыре препарата были одобрены на рынке Европы и на момент запроса данных не получили разрешения от FDA. Лишь один препарат, разрешенный в США, не имеет регистрации в Европе. В Российской Федерации разрешены два лекарственных генотерапевтических препарата: Neovasculgen (2011 год) и Spinraza (2019 год). Это 7% от общего числа всех генотерапевтических препаратов, присутствующих на мировом рынке, и при этом только один из них произведен в Российской Федерации. Таким образом, за 13 лет только один из отечественных генотерапевтических препаратов Neovasculgen российского производства ОАО «Институт стволовых клеток человека» произведен в России и представлен на рынке.
Причины отсутствия на российском рынке инновационных препаратов для предиктивной, превентивной и персонализированной медицины до безобразия банальны и просты: 1. Принимая Федеральный закон №180-ФЗ от 2016 года, авторы и разработчики Федерального закона «узаконили» производство, хранение и оборот БМКП под западные индустриальные стандарты, то есть производство продуктов предиктивной, превентивной и персонализированной медицины должно было соответствовать GMP- и GCP-стандартам Евросоюза и США, а не России. 2. Поскольку в стране вдруг не оказалось в реалиях ни одного такого GMP–производства, то появилась потребность написания целого свода необходимых подзаконных актов, поясняющих и разъясняющих положения новых российских стандартов производства, регламентируемых данным законом. 3. Высокотехнологичные лекарственные препараты (ВТЛП) были предложены в концепции развития здравоохранения стран ЕврАзЭС как реальная альтернатива «выхода из тупика» технологической невозможности многолетнего производства БМКП в России и с тем, чтобы снивелировать грубые методологические ошибки специалистов и разработчиков Федерального закона №180-ФЗ от 2016 года, которые исключили техническую возможность применения в клинике неманипулированных клеточных препаратов, не прошедших культивирование. Главной методологической ошибкой написания данного закона было то, что Министерство здравоохранения России поручило разработать и написать данный «медицинский закон» специалистам-биологам Института биологии развития РАН, которые по большей части отказались внести изменения и правки врачей-клиницистов в окончательную версию данного закона. Сегодня вообще нет полной ясности у разработчиков и будущих производителей продуктов и медицинских организаций, планирующих оказание медицинских услуг в области предиктивной, превентивной и персонализированной медицины, что же надо регистрировать — ВТЛП или БМКП. 4. Еще большая неясность с регистрацией генотерапевтических препаратов в Российской Федерации! Регистрация генотерапевтического препарата Neovasculgen в 2011 году стала возможна только благодаря мощнейшей лоббистской поддержке данной коммерческой организации Государственной корпорацией «РОСНАНО», так как это был ее проект. Сегодня возможность зарегистрировать ГТП в Российской Федерации большинству разработчиков и производителей представляется практически нереальной из-за необоснованных требований Минздрава к производителям данных продуктов. В стране быстрее будет зарегистрирован зарубежный БМКП или ГТП, чем препарат российских разработчиков. 5. Большая часть разработчиков за собственные средства провела весь комплекс доклинических исследований БМКП, но базы GMP-производства для получения в стране практически нет: только две организации сумели получить лицензии в Минздраве на производство БМКП, и они отказываются работать с другими разработчиками или неимоверно высоко поднимают цены на разработку технологических регламентов и необходимых технических документов для предоставления в Министерство здравоохранения России. 6. Организация клинических испытаний новых отечественных БМКП, ВТЛП и ГТЛП для предиктивной, превентивной и персонализированной медицины стоит не менее 300 млн рублей на один препарат при одной нозологии, которые найти разработчикам малых предприятий не под силу, кредитование под такие суммы у банков требует гарантий, которые большинство участников рынка предоставить не могут, а крупные фармацевтические компании, заинтересованные в наших продуктах и способные оплатить подобные расходы, ушли с нашего рынка на неопределенное время. Необходимо устранить все эти причины и обеспечить страну товарами, услугами и необходимым оборудованием для обеспечения потребностей персонализированной медицины.
Глава 2. Клональный гемопоэз — фундаментальная причина возникновения и прогрессирования большинства болезней цивилизации и старения
Что такое термин «гемопоэз», хорошо известно врачам и биологам. Гемопоэз (от др.-греч. αἷμα — кровь и ποίησις — выработка, образование, от ποιεῖν — творить), кроветворение — это процесс образования, развития и созревания клеток крови: лейкоцитов, эритроцитов, тромбоцитов у позвоночных («Википедия», 2024). Под этим термином также понимается весь комплекс органов и тканей системы кроветворения человека и млекопитающих. Классифицируют эмбриональный (внутриутробный) гемопоэз и постэмбриональный гемопоэз. Но в этой главе мы хотели бы обсудить проблему клонального гемопоэза, так как считаем его фундаментальной причиной возникновения и прогрессирования основных болезней цивилизации (БЦ) и главным элементом патогенеза этих болезней (Брюховецкий А. С., Шурдов М. А., 2023). Клональный гемопоэз (КГ) характеризуется наличием популяции клеток крови, происходящих из мутировавших мультипотентных стволовых клеток/клеток-предшественников, которые получили преимущество в аномальном росте (Cacic A. M., Schulz F. I., Germing U. et al., 2023). Это определение КГ, данное исследователями из Дрезденского университета, очень емкое и системное и отражает суть процесса. Как утверждают в журнале Blood в своем научном обзоре по клональному гемопоэзу G. A. Challen and М. A. Goodell (2022), недавнее открытие распространенности клонального кроветворения (КГ) изменило представление врачей-гематологов и онкологов о гемопоэтических стволовых клетках (ГСК). На протяжении десятилетий было признано, что у нас есть множество ГСК, большинство из которых являются излишними и даны нам про запас, на всякий случай. Как правило, ГСК находятся в состоянии покоя, редко делятся, но иногда активируются для дифференцировки. Оценки общего количества ГСК в костном мозге человека варьируются от ∼10 000 (Catlin S. N., Guttorp P., Abkowitz J. L., 2005; Xu J., Wang Y., Guttorp P., Abkowitz J. L., 2018) до ∼200 000 (Lee-Six H., Øbro N. F., Shepherd M. S. et al., 2018; Watson C. J., Papula A. L., Poon GYP et al., 2020). На протяжении всей жизни все соматические клетки непрерывно накапливают мутации, и ГСК не являются исключением, приобретая около 10 мутаций в год (1—2 на клеточное деление; рисунок 1) (Welch J. S., Ley T. J., Link D. C. et al., 2012). Таким образом, к зрелому возрасту (приблизительно 20 лет) большинство наших ГСК будут содержать две кодирующие мутации и 200 некодирующих мутаций (которые также могут влиять на функцию). Если у нас есть 100 000 ГСК, этот 20-летний ребенок накопит порядка 200 000 кодирующих мутаций в примерно 20 000 генов, разбросанных по всему пулу стволовых клеток, что делает все ГСК немного разными. Количество поражений на ген продолжает линейно увеличиваться с возрастом (Welch J. S., Ley T. J., Link D. C. et al., 2012).
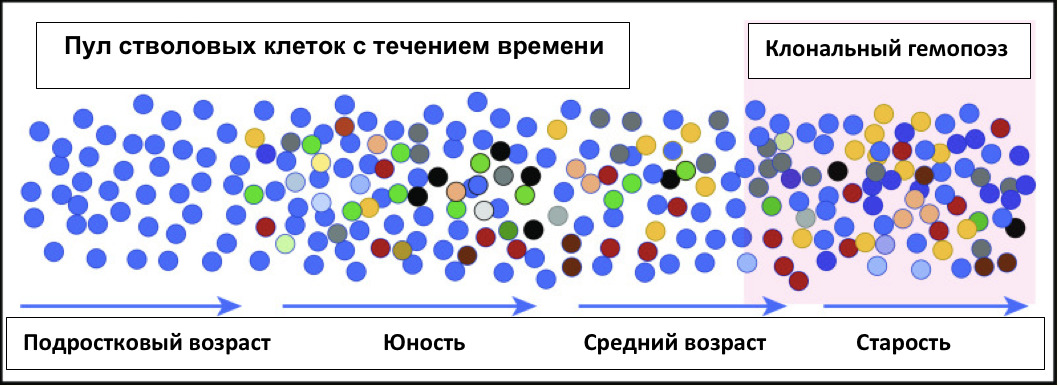
накапливаются со скоростью примерно 10 в год, так что все ГСК немного отличаются у юношества (ранних взрослых). Эти различия проявляются в недостатках и преимуществах для выживания и участия в производстве периферической крови, в результате чего некоторые ГСК «побеждают» с возрастом (эритроциты справа). В то время как расширенные клоны
могут быть обнаружены в среднем возрасте с помощью чувствительных методов секвенирования. В настоящее время принято определение, когда клон достигает доли 4% клеток, измеренных в периферической крови.
Это соответствует частоте вариантного аллеля (VAF) 2%, когда варианты
(мутации) являются гетерозиготными
(Цит. по: Challen G. A. and Goodell M. A., 2020)
Хотя точное количество ГСК у взрослых до сих пор неясно (Xu J., Wang Y., Guttorp P., Abkowitz J. L., 2018), каждый ген получит несколько «попаданий» в течение жизни (в зависимости от размера гена и состава кодонов) (Watson C. J., Papula A. L., Poon GYP et al., 2020), а общее количество кодирующих мутаций распространяется по всей стволовой клетке. Количество мутаций поразительно (потенциально порядка 1 млн к 70 годам). В обзоре S. Jaiswal (2020) показано, что количество мутаций к 70 годам составляет от 350 000 до 1,4 млн нуклеотидных замен.
Эти мутации делают каждую ГСК уникальным «бегуном» с немного отличающимися характеристиками, которые могут помочь или снизить его шансы на победу с течением времени. Считается, что КГ развивается с возрастом в течение очень длительного периода времени, аналогично марафонскому забегу. Подобные ассоциации пришли по поводу КГ к G. A. Challen and M. A. Goodell (2020), которые для иллюстрации и лучшего понимания проводят аналогию КГ на примере марафона. «В марафоне, который начинается с изначально хорошо подобранных бегунов, небольшое преимущество в выносливости может окупиться, в то время как бегун, который тратит большое количество энергии на ранней стадии, может не продержаться долго. Точно так же бегуны, получившие травмы, выбывают из игры. В долгой гонке в игру могут вступить многие второстепенные факторы, включая психологию, погоду и местность. Шанс всегда играет определенную роль, и, наконец, вероятность победы также зависит от количества соревнующихся бегунов». Сочетание общего количества накопленных мутаций в нашей большой продолжительности жизни и исходного размера пула ГСК объясняет неизбежность КГ, которую можно наблюдать с помощью глубокого секвенирования даже в относительно молодом возрасте (Young A. L., Challen G. A., Birmann B. M., Druley T. E., 2012). Хотя флуктуация активности клонов стволовых клеток была оценена давно, в целом вклад стволовых клеток в выработку крови считался довольно стабильным при отсутствии явных заболеваний, таких как лейкемия или недостаточность костного мозга. По сути, КГ является результатом конкуренции долгоживущих стволовых клеток (СК) в костном мозге (КМ). Когда мы экстраполируем эти концепции на КГ, мы задаемся вопросом: как стволовая клетка может «победить»?
G. A. Challen and М. A. Goodell (2022) основное внимание уделили предполагаемым механизмам, которые приводят к КГ, особенно в контексте биологии стволовых клеток, на основе нашего текущего понимания функции некоторых генов, связанных с КГ. Они убеждены, что главная роль в механизмах формирования КГ принадлежит приобретенным дополнительным соматическим мутациям генов. Большинство приобретенных мутаций не имеют значения, а многие даже вредны для функции ГСК, что приводит к их гибели. Редкие мутации, дающие какие-либо преимущества ГСК, со временем увеличат его вероятность доминирования над конкурентами; однако только определенные виды преимуществ со временем проявятся в виде более крупного «клона» ГСК (рисунок 2). Наиболее мощными мутациями будут те, которые приводят к повышенному самообновлению ГСК, создавая больше ГСК, а не сбалансированную дифференцировку. Действительно, в обзоре 150 генов, в котором изучалось влияние нокаута гена (KГ) у мышей, большинство оказывало вредное влияние на функцию ГСК, в то время как некоторые приводили к экспансии ГСК (Rossi L., Lin K. K., Boles N. C. et al., 2012). Интересно, что три из этих генов (DNMT3A, TET2 и Cbl), как позже было показано, периодически мутируют и формируют КГ. Поскольку требуется время для накопления достаточного количества мутаций, а затем для того, чтобы эти мутации показали биологическую экспансию у людей, КГ редко встречается в возрасте до 70 лет, если использовать классическое определение, когда пороговым значением является больше 2% клона VAF в крови. Эти пороги и их клиническая значимость обсуждаются далее в других главах монографии.
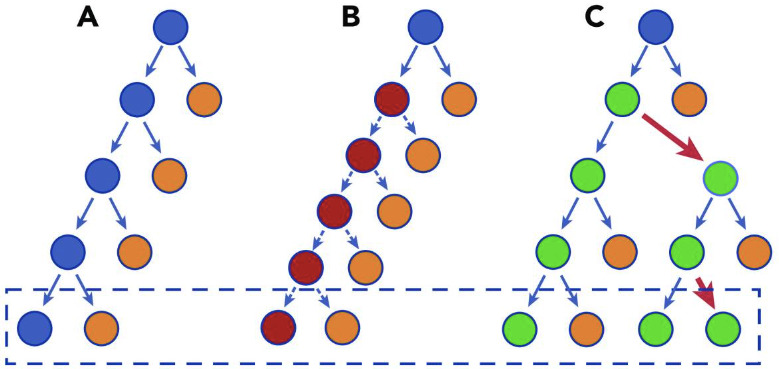
гемопоэзу. (А) Существует баланс между регенерацией стволовых клеток (синий) и дифференцированных клеток (оранжевый). Эта схема не обязательно подразумевает асимметричное деление, но изображает чистый
результат (пунктирная рамка). (В) Стволовая клетка делится быстрее, но каждое решение имеет тот же чистый результат, что и на панели А.
Следовательно, сеть после большого количества клеточных делений
не увеличивает пул стволовых клеток и не превосходит нормальные ГСК. (С) ГСК имеет небольшой уклон в сторону самообновления. Каждые несколько делений (красные стрелки) он создает дисбаланс, так что
со временем в результате образуется больше стволовых клеток.
Скорость, с которой это приводит к действительно предвзятым выводам, будет зависеть от частоты несбалансированных решений. Для большинства генов КГ это, вероятно, изначально очень тонкая предвзятость,
объясняющая очень долгий период времени, в течение которого КГ
становится очевидным (Цит. по: Challen G. A.and Goodell M. A., 2020)
Существует ограниченное количество генов, мутация которых увеличивает самообновление ГСК и проявляется в виде КГ (Рисунок 3). Необходимо было секвенировать достаточное количество людей преклонного возраста, чтобы исчерпывающе идентифицировать все потенциальные гены (Watson C. J., Papula A. L., Poon GYPet al., 2020), но основные игроки, безусловно, были идентифицированы.
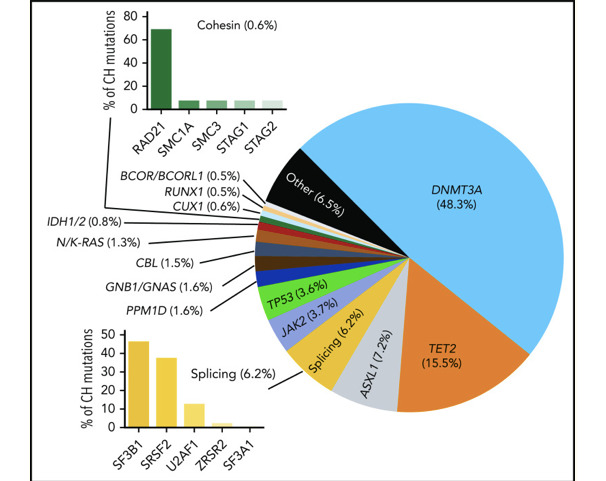
распространенных мутаций клонального гемопоэза (КГ) у людей, которые можно идентифицировать как драйвер. Они варьируются от исследования к исследованию, но указаны общие пропорции (Цит. по: Challen G. A. and Goodell M. A., 2020)
Типы генов, которые рекуррентно мутируют при КГ, в целом делятся на три основных класса: эпигенетические регуляторы, факторы сплайсинга и гены ответа на повреждение ДНК (DDR), с более редким вкладом членов cohesin, сигнальных молекул и гемопоэтических факторов транскрипции.
Мышиные модели оказались полезными, чтобы начать анализ роли, которую играют мутации в этих генах. Генетические манипуляции со многими из этих генов приводят к повышению приспособленности и самообновлению ГСК. В соответствии с концепцией, что небольшие преимущества важны в феномене, который развивается в течение десятилетий, преимущество, обеспечиваемое этими мутациями, часто неуловимо, что приводит к незначительным изменениям в молекулярной и клеточной функции, что затрудняет механистическое объяснение того, как эти мутации работают.
Обобщая вышеизложенные соображения, американские исследователи Grant A. Challen and Margaret A. Goodell (2020) пришли к выводу, что в контексте биологии стволовых клеток и на основе нашего текущего понимания функции некоторых генов, связанных с КГ, нужно понимать то, что, хотя большинство мутаций не оказывают никакого влияния, некоторые из них приводят к тонким функциональным различиям, которые в конечном итоге проявляются в различном поведении стволовых клеток. При большом пуле стволовых клеток и многих десятилетиях конкуренции некоторые из этих различий дают преимущества в определенных условиях. Примерно 20 генов периодически обнаруживаются как мутированные при КГ, что указывает на то, что они дают некоторое преимущество. Влияние этих мутаций начали анализировать на молекулярном уровне путем моделирования на клеточных линиях и на мышах. Мутации в эпигенетических регуляторах, таких как DNMT3A и TET2, дают преимущество, усиливая самообновление стволовых клеток и клеток-предшественников и ингибируя их дифференцировку. Мутации в других генах, участвующих в реакции на повреждение ДНК, могут просто повысить выживаемость клеток.
На рисунке 4 представлены основные стратегии победы, которые используют ГСК для доминирования над другими ГСК костного мозга в организме. Один из путей доминирования ГСК — это стратегия их самообновления, молекулярно-биологической основой которой являются мутации в гене DNMT3A. Другой подход к доминированию среди других клонов кроветворения носит название «стратегии выживания» и обусловлен мутациями в гене ТЕТ2.
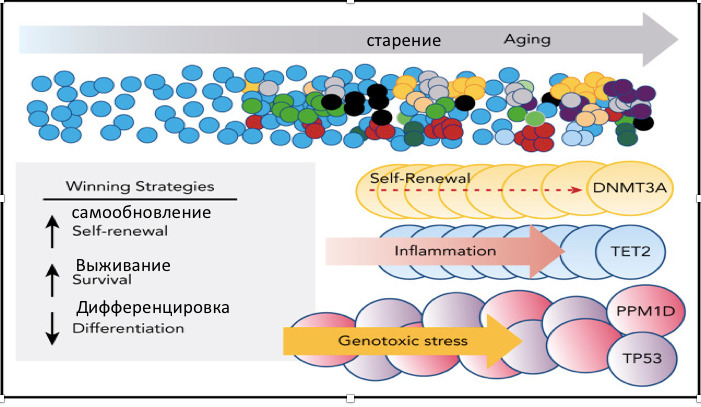
определенных клонов кроветворных стволовых клеток
(Цит. по: Challen G. A. and M.A. Goodell М. А., 2020)
Наличие мутаций гена DNMT3A, кодирующего фермент ДНК-метилтрансферазу de novo, определяет ответственность за установление новых паттернов метилирования ДНК во время развития. Эти мутации свидетельствуют о нарушении принятия решений о судьбе стволовых клеток. Клетки крови, несущие мутации в гене DNMT3А, способны вызывать более сильный иммунный ответ как против нормальных тканей хозяина, так и против опухоли. Мутации в эпигенетических регуляторах, таких как DNMT3A и TET2, дают преимущество, усиливая самообновление стволовых клеток и клеток-предшественников и ингибируя их дифференцировку. Мутации в эпигенетических регуляторах доминируют в ландшафте КГ, при этом около 50% всех мутаций КГ являются вариантами DNMT3A. Большинство мутаций DNMT3A при КГ являются гетерозиготными и, вероятно, приводят к потере функции белка по разным механизмам. Мутации DNMT3A при КГ распространяются по всей длине гена, при этом миссенс-мутации группируются в известных структурных и функциональных доменах. Важно отметить, что спектр вариантов DNMT3A при КГ отличается от наблюдаемого в миелоидных новообразованиях, поскольку он заметно менее обогащен остатком горячей точки R882. Уровень активности DNMT3A, остающийся после мутации, фактически «дозировка» DNMT3A, будет коррелировать со скоростью размножения мутантных клонов. Клональный гемопоэз, ассоциированный с мутациями в этом гене, резко увеличивает риск сердечно-сосудистых заболеваний. Мутации TET2 в гемопоэтических стволовых клетках способствуют самообновлению ГСК, давая им конкурентное преимущество в плане экспансии по сравнению с другими клонами.
Другой подход к доминированию в кроветворении носит название «Стратегии выживания». Эта стратегия направлена на дифференцировку ГСК в результате генотоксического стресса. Эта стратегия обусловлена мутациями в гене ТР53. Соматические мутации в TP53 являются центральными эффекторами реакции на повреждение ДНК, вызванной незащищенными концами теломер. Они повышают вероятность того, что истощение теломер в популяции ГСК отбирает клетки с генетической способностью избегать путей старения без необходимости репарации лежащих в основе дефектов удлинения теломер. Соматические мутации ТР53 опосредуют миелоидную трансформацию при СШД. В исследовании SDS Registry наличие, количество и распространенность аллелей соматического гена TP53 и мутации в нем не были предикторами неминуемого риска лейкемии у пациентов с СШД. Вместо этого прогрессирование мутантных по TP53 клонов было опосредовано развитием биаллельных изменений в локусе TP53, делецией, потерей гетерозиготности с нейтральной копией или второй точечной мутацией. В функциональных экспериментах было показано, что инактивация TP53 повышает конкурентоспособность SBDS-дефицитных клеток за счет инактивации путей старения без коррекции лежащих в основе SDS рибосом и дефектов трансляции. В соответствии с этими генетическими наблюдениями человека потеря TP53 может разъединить рибосомный стресс, вызванный дефицитом SBDS, от активации путей клеточного старения, что приводит к частичному восстановлению фенотипа СШД. Инактивация TP53 ограничивает клеточные последствия неэффективности трансляции и дефектной длины теломер, соответственно указывая на то, что активация пути p53 ограничивает относительную приспособленность и опосредует устранение «неудачников». Таким образом, инактивация TP53 в одиночных клонах ГСК может превратить «проигравших» в «победителей», что согласуется с наблюдаемым рецидивом соматических мутаций TP53 при КГ и миелоидных новообразованиях, возникающих при SDS и нарушениях биологии теломер.
Революция в области анализа отдельных клеток выявила гетерогенность популяций определенных типов клеток, и все чаще признается, что клональная экспансия отдельных клеток лежит в основе ряда заболеваний, помимо рака, включая сосудистые патологии, цирроз и нейродегенерацию (Brunner et al., 2019; Chappell et al., 2016; Dobnikar et al., 2018; Jacobsen et al., 2017; Misra et al., 2018; Sheikh et al., 2015; Tay et al., 2017). Например, множественные предшественники гладкомышечных клеток (ГМК) дают начало нормальной артериальной стенке во время развития, но несколько избранных предшественников внутри стенки участвуют в формировании атеросклеротических бляшек (Chappell et al., 2016; Greif et al., 2012; Jacobsen et al.., 2017; Misra et al., 2018). Кроме того, при возрастном клональном кроветворении с неопределенным потенциалом (от англ. clonal haematopoiesis of indeterminate potential или сокращенно — CHIP) стволовые клетки, несущие соматические мутации, дают доминантные варианты лейкоцитов, а CHIP ассоциируется с повышенным риском серьезных заболеваний, связанных с атеросклерозом, инфарктом миокарда и ишемическим инсультом (Jaiswal S. and Libby, 2020; Jaswal S. et al., 2017).
Клональный гемопоэз неопределенного потенциала (CHIP) уже некоторое время привлекает внимание медицинского сообщества. Как утверждают A. M. Cacic, F. I. Schulz, U. Germing et al. (2023), этот феномен, обнаруженный около десяти лет назад, связывает возрастные изменения кроветворения не только с более поздним развитием гематологических злокачественных новообразований, но и с повышенным риском ранних сердечно-сосудистых заболеваний и некоторых других заболеваний. CHIP выявляется в крови и характеризуется клонально расширенными соматическими мутациями в генах, связанных с раком, предрасполагающих к развитию гематологических новообразований, таких как миелодиспластический синдром (МДС) и острый миелолейкоз (ОМЛ). Связанные с CHIP мутации часто затрагивают гены восстановления повреждений ДНК и нередко отмечаются после предшествующей цитотоксической терапии рака. Генетическая предрасположенность, по-видимому, является фактором, способствующим этому. Стало неожиданностью, что CHIP значительно повышает риск инфаркта миокарда и инсульта, а также способствует развитию сердечной недостаточности и легочной гипертензии.
Недавние исследования на людях указывают на подобное прогрессирующее накопление мутантных соматических клонов в эпителиальных клетках различных органов при нормальном старении (Martincorena et al., 2018; Martincorena et al., 2015; Moore et al., 2020; Yoshida et al., 2020). Исследования в основном были сосредоточены на автономных клеточных механизмах, лежащих в основе клональной экспансии, а неклеточная автономная регуляция недостаточно хорошо изучена, особенно при старении и возрастзависимых болезнях цивилизации. Примечательно, что недавнее неоднозначное биоинформатическое исследование ставит под сомнение точку зрения о том, что увеличение соматических мутаций с возрастом лежит в основе повышенной заболеваемости раком в более позднем возрасте, и вместо этого утверждает, что снижение иммунной системы имеет первостепенное значение (Palmer et al., 2018).
Y. Ran, Z. Gu, Y. Lyu et al. (2022) исследовали феномен неклеточной автономной регуляции клональности при старении, определяя роль старых гемопоэтических клеток в модулировании рекрутирования и клональной экспансии клеток-предшественников (КП) гладкомышечных клеток (ГМК) в атеросклеротической бляшке. Они показали, что воспалительные клетки, особенно макрофаги, и КП ГМК играют ключевую роль в атерогенезе. Редкие предшественники ГМК из средней оболочки вносят свой вклад в клетки, которые заселяют зарождающуюся бляшку и клонально расширяются, приводя к ∼30—70% клеточности развитой бляшки с клетками, формирующими защитный фиброзный колпачок или переходящими в дестабилизирующие судьбы бляшки (Basatemur et al., 2019; Chappell et al., 2016; Jacobsen et al., 2017; Misra et al., 2018; Shankman et al., 2015; Wirka et al., 2019). Интегрины представляют собой гетеродимерные белки, которые связывают внеклеточные и внутриклеточные компартменты, а трансплантат костного мозга (BM), лишенный гена, кодирующего интегрин β3 (Itgb3), у мышей с атеропронами, индуцирует множественные предшественники SMC для проникновения в бляшку и клонального расширения, усугубляя бремя болезни (Misra et al., 2018; Schneider et al., 2007). На фоне Apoe (-/-) макрофаги, происходящие из Itgb3 (-/-) КМ, имеют повышенные уровни цитокина фактора некроза опухоли (TNF) -α (Schneider et al., 2007). Уровни TNFα в плазме повышены у старых мышей и людей, а высокие уровни TNFα у пожилых людей коррелируют с атеросклерозом (Bauernfeind et al., 2016; Bruunsgaard et al., 2000). Важно отметить, что трансплантация КМ (ТКМ) от старых мышей молодым мышам усугубляет атеросклероз (Du et al., 2016), но основные механизмы и эффекты на рекрутирование и клональность SMC не определены.
При CHIP клонально расширенные гемопоэтические стволовые клетки обычно содержат соматические мутации в эпигенетических регуляторах, таких как Ten Eleven Translocation (TET) — 2 (Jaiswal and Libby, 2020; Jaiswal et al., 2017). На нулевом фоне рецептора липопротеинов низкой плотности (Ldlr) КМ с дефицитом TET2 предрасполагает мышей к развитию атеросклероза, вызванного усиленной западной диетой, а макрофаги, выделенные от мышей TET2 (-/-), экспрессируют повышенные уровни цитокинов, включая TNFα. (Fuster et al., 2017; Jaiswal et al., 2017). Макрофаги, привлеченные к ранним атеросклеротическим бляшкам, локально пролиферируют во время прогрессирования заболевания (Robbins et al., 2013), а у мышей с атеропрозом инициация БВ у пожилых людей по сравнению с молодыми увеличивает накопление макрофагов в аорте (Du et al., 2016). Важно отметить, что в контексте CHIP у людей, или у старых мышей, или мышей с дефицитом миелоидных клеток TET2 клональность миелоидных клеток в самих атеросклеротических бляшках неуловима. Подобно старению, влияние дефицита КМ TET2 на клональность ГМК в бляшке не определено.
Показано, что возраст КM является ключевым фактором, определяющим клональность клеток, происходящих из ГМК, в атеросклеротической бляшке: состарившийся неклеточный КМ автономно индуцирует рекрутирование и экспансию множества предшественников ГМК. Механически сниженные уровни TET2 в старых моноцитах/макрофагах эпигенетически снижают экспрессию гена Itgb3, что усиливает передачу сигналов TNFα-TNF рецептора 1 (TNFR1). Таким образом, возникает поликлональность линии ГМК и более выраженный атеросклероз (Ran Y., Gu Z., Lyu Y. et al., 2022).
Но вопрос о том, что же является мотором и главным двигателем патогенеза и прогрессирования болезней цивилизации (БЦ) и постоянно поддерживает эту «неустойчивость генома» высокоспециализированных клеток организма при наличии или отсутствии генетического дефекта в их геноме и почему приводит к закономерному исходу болезни, очень долго оставался открытым. На основании почти 35-летнего опыта применения различных типов клеточной терапии у человека мы пришли к выводу, что таким молекулярно-биологическим двигателем является клональный гематопоэз, обусловленный геномным и постгеномным повреждением аутологичных гемопоэтических стволовых клеток (ГСК) и гемопоэтических клеток-предшественников (ГКП) костного мозга. ГСК и ГПК — главные системообразующие и главные регуляторные клеточные системы крови и родоначальники всех иммунокомпетентных клеток иммунной системы организма млекопитающих и человека! Именно ГСК и ГПК формируют системообразующие иммунноспецифические (иммунотолерантные или иммуноагрессивные) реакции организма человека и животных на клетки с неустойчивым геномом и определяют их судьбу. Это показано новыми знаниями о том, что ГСК и ГКП, с одной стороны, являются самыми медленными клетками в организме (их клеточный цикл от 22 до 50 недель или почти 360 дней) и формируют все иммунные реакции и иммунную память в организме (Seiweke М. et al., 2021). С другой стороны, кроме функций репродукции клеток крови и иммунокомпетентных клеток крови, а также формирования иммунных реакций, они являются главными регуляторными и управляющими системами организма всех млекопитающих. Под их управлением и в подсистемах к ним находятся все 230 известных типов клеток организма человека (Alberts B., Johnson A., Lewis J. еt al., 2007). Изменение геномной и протеомной структуры ГСК и ГПК, как самых длительно живущих клеток в организме, происходит в результате накопления в них драматических дополнительных соматических мутаций (ДСМ). В результате формируются и постепенно расширяются патологические клоны ГСК и ГКП и их потомки начинают доминировать в гемопоэзе и циркуляторном русле (Jaiswal S., Ebert B. L., 2019; Mitchell E., Chapman M. S., Williams N. et al., 2022).
Как отмечает в своем научном обзоре S. Jaiswal (2020), революция в области анализа отдельных клеток выявила гетерогенность популяций определенных типов клеток, и сегодня признается, что клональная экспансия отдельных клеток лежит в основе этиопатогенеза ряда таких заболеваний, как рак, сосудистые заболевания, цирроз и нейродегенерации (Brunner et al., 2019; Chappell et al., 2016; Dobnikar et al., 2018; Jacobsen et al., 2017; Misra et al., 2018; Sheikh et al., 2015; Tay et al., 2017). Парадокс заключается в том, что, например, множественные предшественники гладкомышечных клеток дают начало нормальной артериальной стенке во время развития, но несколько избранных предшественников внутри стенки участвуют в формировании атеросклеротических бляшек (Chappell et al., 2016; Greif et al., 2012; Jacobsen et al. 2017; Misra et al., 2018). Кроме того, при возрастном клональном кроветворении стволовые клетки, несущие соматические мутации, дают доминантные варианты лейкоцитов, а появление патоспецифических клонов связано с повышенным риском серьезных заболеваний, асоциированных с атеросклерозом, инфарктом миокарда и ишемическим инсультом (Jaiswal S. & Lybbi, 2020; Jaiswal S. et al., 2017). Недавние исследования на людях указывают на подобное прогрессирующее накопление мутантных соматических клонов в эпителиальных клетках различных органов, что характерно и для нормального старения (Martincorena et al., 2018; Martincorena et al., 2015; Moore et al., 2020; Yoshida et al., 2020). Показано, что ДСМ со временем накапливаются во всех клетках (Welch J. S., Ley T. J., Link D. C. et al., 2012; Alexandrov L. B., Jones P. H., Wedge D. C. et al., 2015; Martincorena I., Campbell P. J., 2015; Blokzijl F., de Ligt J., Jager M. et al., 2016; Hoang M. L., Kinde I., Tomasetti C. et al., 2016). Эти ДСМ чаще всего представляют собой замены оснований (известные как однонуклеотидные варианты), небольшие вставки, или делеции (indels), или изменения числа копий больших хромосомных областей (известные как структурные варианты). По оценкам, ГСК приобретают примерно 20 соматических мутаций в год во всем геноме (Lee-Six H., Øbro N. F., Shepherd M. S. et al., 2018; Osorio F. G., Rosendahl Huber A., Oka R. et al., 2018) и примерно 0,1 мутации в год в экзонах, кодирующих белок (Welch J. S., Ley T. J., Link D. C. et al., 2012), подавляющее большинство из которых являются однонуклеотидными вариантами. В костном мозге только долгоживущие ГСК обладают способностью к самообновлению на протяжении всей жизни организма (Reya T., Morrison S. J., Clarke M. F., Weissman I. L., 2001). Поэтому в большинстве случаев только мутации, возникающие в ГСК, сохраняются на протяжении всей жизни человека. Учитывая, что на человека приходится от ∼50 000 до ∼200 000 ГСК, считается, что к 70 годам у людей насчитывается от 350 000 до 1 400 000 кодирующих мутаций в пуле ГСК. Если хотя бы одна из этих мутаций способна обеспечить селективное преимущество в отношении ГСК, в котором она возникает, клональная экспансия в крови должна быть обычным явлением при старении (Jaiswal S., Ebert B. L., 2019). Действительно, это явление, называемое клональным гематопоэзом, тесно связано со старением и показано в нескольких исследованиях лиц, не отобранных для исследования гематологических нарушений (Xie M., Lu C., Wang J. et al., 2014; Genovese G., Kähler A. K., Handsaker R. E. et al., 2014; Jaiswal S., Fontanillas P., Flannick J. et al., 2014; McKerrell T., Park N., Moreno T. et al., 2015; Buscarlet M., Provost S., Zada Y. F. et al., 2017; Acuna-Hidalgo R., Sengul H., Steehouwer M. et al., 2017; Coombs C. C., Zehir A., Devlin S. M. et al., 2017).
По мнению S. Jaiswal (2020), в большинстве исследований мутации, используемые для определения клонального кроветворения, аналогичны мутациям, обнаруживаемым при гематологическом раке (Jaiswal S., Fontanillas P., Flannick J. et al., 2014; Coombs C. C., Zehir A., Devlin S. M. et al., 2017). Наиболее часто мутирующие гены в клональном кроветворении включают DNMT3A, TET2, ASXL1, JAK2, TP53 и SF3B1, которые также часто мутируют при остром миелоидном лейкозе (Ley T. J., Miller C., Ding L. et al., 2013; Lindsley R. C., Mar B.G., Mazzola E. et al., 2015), миелодиспластическом синдроме (МДС) (Bejar R., Stevenson K., Abdel-Wahab O. et al., 2011; Papaemmanuil E., Gerstung M., Malcovati L. et al., 2013) и миелопролиферативных новообразованиях (МПН) (Nangalia J., Massie C. E., Baxter E. J. et al., 2013). Следовательно, неудивительно, что у людей с клональным гематопоэзом эти виды рака развиваются с большей скоростью, чем у людей без мутаций (Genovese G., Kähler A. K., Handsaker R. E. et al., 2014; Abelson S., Collord G., Ng S. W. K. et al., 2018; Jaiswal S., Fontanillas P., Flannick J. et al., 2014; Desai P., Mencia-Trinchant N., Savenkov O. et al., 2018; Bolton K. L., Ptashkin R. N., Gao T. et al., 2019). Однако мутации, вызывающие клональное кроветворение, также могут быть обнаружены в циркулирующих иммунных клетках, таких как гранулоциты, моноциты и лимфоциты. Это открытие повышает вероятность того, что клональное кроветворение может привести к измененным иммунным ответам, которые потенциально могут влиять на многие болезни старения (Mitchell E., Chapman M. S., Williams N. et al., 2022).
Клональное кроветворение относится к любому состоянию клональной экспансии в кроветворной системе. Рак крови, такой как хронический миелоидный лейкоз или МДС, является типичным примером клонального кроветворения. Однако те же самые мутации, обнаруженные при этих видах рака, также наблюдаются у значительной части здорового пожилого населения. Чтобы отличить наличие этих мутаций в незлокачественных условиях от злокачественного клонального кроветворения, был введен термин «клональный гематопоэз с неопределенным потенциалом» (CHIP) (Steensma D. P., Bejar R., Jaiswal S. et al., 2015). CHIP определяется наличием связанной с раком соматической мутации в крови или костном мозге у лиц без известных гематологических раковых заболеваний или других клональных состояний, таких как моноклональная гаммапатия.
По мнению S. Jaiswal (2020), еще одним аспектом определения CHIP является нижняя граница размера клона. Во всех исследованиях клонального кроветворения на сегодняшний день распределение размеров клонов правостороннее, то есть людей с меньшими клонами намного больше, чем с большими клонами. В своем логическом расширении это наблюдение предсказывает, что очень маленькие клоны должны присутствовать почти у всех людей, что впоследствии было продемонстрировано экспериментально (Young A. L., Challen G. A., Birmann B. M., Druley T. E., 2016; Razavi P., Li B. T., Brown D. N. et al., 2019).
Если эти очень маленькие клоны присутствуют почти у всех, то уже нет значимого различия быть носителем клонального кроветворения. Из-за этого факта S. Jaiswal (2020) было предположено, что CHIP должен присутствовать при фракции вариантных аллелей (VAF)> 0,02 (это означает, что> 2% секвенированных аллелей несут мутацию, что соответствует ~ 4% клеток для гетерозиготных мутаций). Некоторые комментарии предполагают, что CHIP является «техническим» определением, поскольку этот предел приблизительно соответствует уровню обнаружения при секвенировании всего экзома. S. Jaiswal (2020) предпочитает думать о CHIP как о разумном рабочем определении: учитывая вышеупомянутые результаты очень маленьких клонов у большинства людей, пороговое значение VAF является требованием для практического дизайна исследований.
В частности, клональный гемопоэз неопределенного потенциала (CHIP), как это определено в новой классификации гематолимфоидных опухолей ВОЗ, относится к CH (КГ) с соматическими мутациями в генах, связанных со злокачественными миелоидными новообразованиями, обнаруженными в крови или костном мозге с частотой вариантного аллеля (VAF) ≥2% у лиц без диагностированных гематологических нарушений или необъяснимой цитопении (Steensma D. P, Bejar R., Jaiswal S. et al., 2015; Khoury J. D., Solary E., Abla O. et al., 2022; Arber D. A., Orazi A., Hasserjian R. P. et al., 2022). Следует подчеркнуть, что ЧИП еще не является заболеванием, поскольку принятое определение исключает стойкую (≥4 мес.) цитопению и явную патологию, связанную с соматическим поражением (Valent P., Orazi A., Steensma D. P. et al., 2017; Arber D. A., Orazi A., Hasserjian R. P. et al., 2022). Используя ВАФ ≥2% в качестве порогового значения, до 20% людей старше 70 лет имеют обнаруживаемый КГ (Jaiswal S., Fontanillas P., Flannick J. et al., 2014; Genovese G., Kähler A. K., Handsaker R. E. et al., 2014; Xie M., Xie M., Lu C. et al., 2014). Немецкие исследователи установили, что, учитывая демографию в Германии, по оценкам, пострадало 2,75 млн человек (Heuser M., Thol F., Ganser A. et al., 2016). Что касается отдельного человека с клональным гемопоэзом (КГ), сообщалось о внутрииндивидуальной гетерогенности, при этом наблюдались различия между пораженными клеточными линиями, тканевыми компартментами (периферическая кровь по сравнению с костным мозгом) и анатомическими местоположениями (Hartmann L., Hecker J. S., Rothenberg-Thurley M. et al., 2022).
Мутации CHIP могут возникать как в миелоидной линии (известной как M-CHIP), так и в лимфоидной линии (известной как L-CHIP) кроветворной системы (Niroula A., Sekar A., Murakami M. A. et al., 2021). Мутации как миелоидных, так и лимфоидных соматических генов, а также миелоидные и лимфоидные мозаичные хромосомные изменения (mCA) связаны с риском развития гематологических злокачественных новообразований, специфичных для данной линии (Niroula A,. Sekar A., Murakami M. A. et al., 2021). В случае M-CHIP большинство мутаций обнаружено в трех генах, а именно DNMT3A, TET2 и ASXL1 (Niroula A., Sekar A., Murakami M. A. et al., 2021). Соматические мутации при миелоидно-ориентированном КГ коррелируют с повышенным риском миелоидных злокачественных новообразований, сердечно-сосудистых заболеваний (ССЗ) и смертности от всех причин (Von Beck K., Von Beck T., Ferrell P. B. et al., 2023). L-CHIP, по-видимому, распределяется более равномерно по большему числу генов, что напоминает распределение вариантов в остальных генах M-CHIP (Niroula A., Sekar A., Murakami M. A. et al., 2021). Соматические мутации при лимфоидно-обусловленном CH связаны с развитием лимфоидных злокачественных новообразований и поздними проявлениями аутоиммунитета и иммунодефицита (Von Beck K., Von Beck T., Ferrell P. B. et al., 2023).
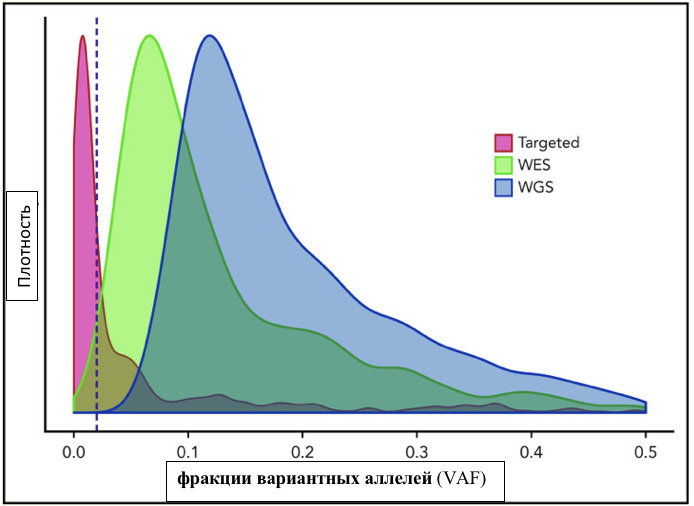
аллеля (VAF) 0,02, пороговое значение для CHIP. Глубина охвата является основным фактором, определяющим форму распределения VAF
На самом деле CHIP не только технический термин, но уже это существующая определенность изменений генома в виде мутаций генов на уровне ДНК. При этом СНIP остается неопределенностью своего клинического проявления, так как комбинациям одних и тех же мутаций может соответствовать разная клиническая картина заболевания. Как утверждал академик А. И. Арчаков: «Геном — это эскиз, транскриптом — это чертеж, а протеом — это уже готовое изделие». Поэтому на уровне генома наличие мутаций в генах клональности всего лишь является «эскизом» или «наброском» тех катастрофических последствий клонального гемопоэза у человека, проявляющихся в виде дополнительных соматических мутаций ДНК хроматина клеток человека. Именно поэтому при секвенировании генома мы получаем клональный гемопоэз с неопределенным потенциалом. На уровне транскриптома клональный гемопоэз начинает демонстрировать основные черты будущей трансформации СК и проявляется определенным набором нарушений экспрессии РНК, продуцируемых мутантными генами клональности. Поэтому на транкриптомном уровне исследования РНК стволовых клеток можно убедительно увидеть формирование генетических полиморфизмов рака, сердечно-сосудистых нарушений и других молекулярно-биологических изменений. Неопределенность начинает отступать уже на этом уровне, и в большинстве случаев по транскриптомному профилю РНК можно уже диагностировать ряд тяжелых гематоонкологических болезней и различные формы рака. Поэтому картирование и профилирование экспрессии РНК позволяет в ряде случаев диагностировать сложные болезни цивилизации, которые на генетическом уровне выявить не удается. На уровне протеома уже формируется молекулярная специфичность белков патологии кроветворной стволовой клетки и выявляется патоспецифичность и нозоспецифичность клонального гемопоэза. На протеомном уровне исчезает неопределенность в диагностике нарушений кроветворения и гемопоэз приобретает черты определенной специфичности: онкоспецифичности, нейроспецифичности, кардиоспецифичности, аутоиммунной специфичности и т. д.
Идентифицированные к настоящему времени клоны CHIP демонстрируют ряд крупномасштабных mCA, включая делеции, дупликации и копировально-нейтральную потерю гетерозиготности (CN-LOH) на всех хромосомах (Jacobs K. B., Yeager M., Zhou W. et al., 2012; Laurie C. C., Laurie C. A., Rice K. et al., 2012; Machiela M. J., Zhou W., Sampson J. N. et al., 2015; Loh P-R, Genovese G., Handsaker R. E. et al.,2016). КГ, вызванный mCA, в первую очередь предрасполагает к лимфоидным злокачественным новообразованиям, таким как хронический лимфоцитарный лейкоз (ХЛЛ), и связан с двукратным увеличением смертности от всех причин (Loh P.-R., Genovese G., Handsaker R. E. et al., 2016; Loh P.-R., Genovese G., McCarroll S. A., 2020). В частности, было продемонстрировано, что события, связанные с CN-LOH с мутацией JAK2, значительно повышают сердечно-сосудистый риск (Loh P.-R., Genovese G, McCarroll S. A., 2020). Кроме того, mCA-ассоциированный CH может привести к нарушению иммунной функции, что делает людей более восприимчивыми к инфекциям (Zekavat S. M., Lin S-H, Bick A. G. et al., 2020).
Опять же, важно отметить, что термин CHIP следует применять только к людям с нормальными показателями крови (Valent P., Kern W., Hoermann G. et al., 2019). В случаях, когда CHIP идентифицируется наряду с одной или несколькими персистирующими цитопениями, которые иначе не объясняются гематологическими или негематологическими состояниями и которые не соответствуют диагностическим критериям определенных миелоидных новообразований (МН), состояние называют CCUS (клональная цитопения неопределенного происхождения) (Khoury J. D., Solary E., Abla O. et al., 2022). И CCUS, и CHIP становятся более распространенными с возрастом и относительно распространены среди пожилых людей (Arber D. A., Orazi A., Hasserjian R. P. et al., 2022). Пациенты с CHIP имеют повышенный риск развития ЗНO по сравнению с контрольной группой без CHIP (Busque L., Patel J. P., Figueroa M. E. et al., 2012; Malcovati L., Cazzola M., 2015; Sperling A. S., Gibson C. J., Ebert B. L., 2017), а также имеют повышенный риск развития прогрессирующего атеросклероза и связанных с ним сердечно-сосудистых заболеваний (Jaiswal S., Fontanillas P., Flannick J. et al., 2014; Jaiswal S., Natarajan P., Silver A. J. et al., 2017). Однако следует отметить, что у большинства пациентов с CHIP не проявляется ни злокачественность, ни тяжелые сердечно-сосудистые заболевания (Valent P., Kern W., Hoermann G. et al., 2019).
По мнению A. M. Cacic, F. I. Schulz, U. Germing et al. (2023), понимание сложной взаимосвязи между генетической предрасположенностью, соматическими мутациями и влиянием окружающей среды имеет решающее значение для понимания сложностей CHIP и его последствий для здоровья. Генетическая предрасположенность, по-видимому, играет значительную роль, способствуя накоплению соматических мутаций в гемопоэтических стволовых клетках (ГСК). Некоторые из этих мутаций являются ключевыми факторами CHIP. Приобретение мутаций КГ происходит посредством естественных механизмов во время старения, таких как точечные мутации из-за спонтанного дезаминирования 5-метилцитозина в тимин (Alexandrov L. B., Nik-Zainal S.,Wedge D. C. et al., 2013), или, реже, из-за ошибок во время восстановления двухцепочечных разрывов ДНК, создающих небольшие вставки/делеции (инделеции), или из-за ошибок репликации, вызванных ДНК-полимеразой (Jaiswal S., Ebert B. L., 2019).
Очевидно, что клональные молекулярно-биологические изменения ГСК и ГПК нарушают поликлональность кроветворения и приводят к формирования моно- и олигоклонального гемопоэза при старении и практически при всех основных болезнях цивилизации (БЦ). Моно- и олигоклональный гемопоэз в целом ряде случаев имеет важнейшее место в патогенезе большинства онкологических, неврологических и сердечно-сосудистых болезней и старения (Jaiswal S., 2020). Более того, в 2014 году сообщалось, что клональный гемопоэз с неопределенным потенциалом был связан с повышением смертности людей более чем на 40%, что нельзя было объяснить только гематологическим раком (Jaiswal S., Fontanillas P., Flannick J. et al., 2014). Одним из рекомендуемых научных подходов к лечению многих болезней цивилизации и даже профилактике старения может стать биотехнология, основанная на блокировании молекулярных механизмов клонального гемопоэза (Jaiswal S., 2020) путем генотерапии. Однако технологического решения для реализации этого подхода пока не существует. Возможным решением проблемы может стать блокировка репродуктивных функций доминирующего клона (клонов) кроветворения, что может позволить добиться их постепенного вырождения и исчезновения. Еще одним подходом к блокировке доминирующего клона кроветворения может стать его реставрация и восстановление повреждений ДНК в нем путем природоподобного изменения генома доминирующего клона ГСК и ГПК. Как первый, так и второй методологический подход к блокировке и реставрации патологического клона кроветворения способны привести к физиологическому блокированию репродуктивных и функциональных свойств этих клеточных систем, позволят снизить процентное количество патоспецифичных (иммунотолерантных или иммуноагрессивных) иммунокомпетентных потомков этих клеток в циркулирующей крови организма человека и животных с моно- или олигоклональным гемопоэзом и за счет активации подавленных клонов ГСК и ГПК восстановить поликлональность кроветворения. Эта методология позволит остановить или профилактировать прогрессирование патологических процессов болезни или старения и даже предотвращать внезапную смерть.
Разработка и создание природоподобного генотерапевтического способа лечения онкологических, нейродегенеративных, сердечно-сосудистых заболеваний и наследственных нервных болезней цивилизации и профилактики старения путем блокирования моно- и олигоклональности гемопоэза позволят восстановить поликлональность кроветворения больного человека. Нами был предложен метод молекулярной геномной балансировки хроматина доминирующих патоспецифических клонов аутологичных ГСК и ГКП фрагментированной до размера 1—10 нуклеосомных мономеров геномной ДНК человека (hDNAnmr), а также определение ее молекулярно-биологического потенциала и перспектив клинического применения для предотвращения внезапной смерти, профилактики прогрессирования фатальных болезней цивилизации, увеличения средней продолжительности жизни и активного долголетия у пожилых и старых млекопитающих и человека. Однако главным вопросом проблемы клонального гемопоэза является ранняя диагностика этого патологического состояния.
В следующей главе мы подробно остановимся на описании возможностей диагностики данной патологии.
Глава 3. Ультраранняя геномная и постгеномная диагностика клонального гемопоэза при фатальных болезнях цивилизации
Несмотря на существенный прогресс мировой медицинской науки и значительные достижения современной медицины в лечении целого ряда болезней цивилизации (БЦ), существует группа неизлечимых смертельных заболеваний, диагностика которых на ранней стадии затруднена, а эффективного лечения их пока не существует. К этим неизлечимым БЦ относятся в первую очередь злокачественные новообразования (ЗНО) и нейродегенеративные болезни (НДБ). Показано, что определенные формы рака (рак легких, рак печени, рак поджелудочной железы и т. д.) и других ЗНО (некоторые гемабластозы, мультиформная глиобластома, меланома и др.) неизлечимы и фатальны. Также не существует способов ранней молекулярной диагностики большинства НДБ, их адекватного лечения и возможности предотвращения быстрого летального исхода. Особенно это наглядно на примере бокового амиотрофического склероза (БАС), который еще современные неврологи называют болезнью моторного нейрона (БМН). Время жизни пациентов с установленными диагнозами некурабельного рака и ряда неизлечимых ЗНО составляет 1—3 года. До 5 лет и более с этими диагнозами доживают 10—15% больных. Время жизни больных с диагностированным БАС 2—3 года, и ни один из современных методов лечения не эффективен и не способен предотвратить летальный исход этой болезни. Диагностика этих фатальных заболеваний — это «приговор без права на помилование», так как реальных причин и патогенетических механизмов этих заболеваний не установлено и именно поэтому не найдено их эффективного лечения.
Если мысленно представить перед собой линейную плоскость, на которой находились бы все существующие смертельные заболевания человека, то злокачественные опухоли расположатся на ней на одной стороне, а на противоположной стороне находился бы БАС, БА, БП и другие НДБ. Эти действительно две крайние точки в существующем континууме известных заболеваний организма человека и две крайние противоположности среди всех смертельных болезней человечества. БАС, БА и БП — это заболевания, которые сопровождаются массивной нейродегенерацией, гипотрофией и атрофией мышц и формированием синдромов «минус-ткань» в нервной системе, а злокачественные новообразования, наоборот, сопровождаются пролиферацией, отеком ткани, разрастанием и миграцией клеток и формированием синдрома «плюс-ткань». Поэтому мы предположили, что сравнительный анализ этих двух противоположных патологических феноменов разных смертельных болезней может дать ключ к решению проблемы ранней диагностики и при других малокурабельных НДБ нервной системы.
Очевидно, что ранняя диагностика любого неизлечимого заболевания у человека дает ему определенный шанс на увеличение продолжительности жизни и последующего выживания в результате своевременно начатого лечения. В современной онкологии существует ранняя молекулярно-биологическая диагностика (МБД) рака и других ЗНО, которая основана на выявлении молекул онкоспецифических белков (ОСБ), или так называемых онкомаркеров, в биологических жидкостях пациента (кровь, моча, ликвор и т. д.). Онкомаркеры позволяют выявить у человека рак и ЗНО на 1—2-й стадии и после адекватного лечения обеспечить ему 5-летнюю медиану выживаемости. Есть данные, что показатели выживаемости от рака увеличиваются в 2—3 раза именно из-за ранней диагностики ЗНО с использованием онкомаркеров в виде ОСБ, и это способствует повышению медианы 5-летней выживаемости раковых больных в 2—3 раза, а в ряде случаев способствует и полному выздоровлению больных. Однако не все так хорошо и радужно, как сегодня нам представляют современные онкологи. На самом деле современные критерии ранней диагностики рака и ЗНО позволяют диагностировать канцерогенный процесс только тогда, когда он уже приобрел определенную канцерогенную тканеспецифичность и локацию в органе, что зачастую бывает достаточно поздно, так что рак, при минимальном первичном очаге и высокой злокачественности, уже дал множественные отдаленные метастазы в органы и ткани. Обнаружение онкомаркеров позволяет заподозрить наличие тканеспецифических молекул опухоли в организме, проводить масштабные скрининговые исследования и отслеживать динамику болезни в процессе лечения. При выявлении в процессе скрининга повышенного уровня одного из онкомаркеров требуется проведение дополнительных методов исследования, без которых постановка диагноза неправомочна.
Диагноз большинства НДБ, как правило, ставится на основании анализа клинической картины болезни и результатов нейрофизиологической диагностики и/или анализа результатов лучевой диагностики (КТ, КТ с контрастированием, ПЭТ/КТ, МРТ, МРТ в ангиорежиме, функциональное МРТ). Например, боковой амиотрофический склероз (от англ. Amyotrophic Lateralis Sclerosis или сокращенно АLS) или болезнь моторного нейрона (БМН) устанавливают только клинически и по данным игольчатой электронейромиографии (ЭНМГ) с вызванными сомато-сенсорными потенциалами, когда больного уже спасти практически невозможно и у него остались здоровыми не более 10—15% мотонейронов в нервной ткани головного и спинного мозга. Ранней молекулярно-биологической диагностики (МБД) и реального эффективного лечения при АLS нет. Диагностика БАС по наличию молекул нейрофиламентов возможна только на этапе массивной дегенерации мотонейронов, когда их осталось в живых менее 10—15%. Диагностика тау-белков при БА или телец Леви при БП также становится возможной только при тяжелой деструкции корковых нейронов при БА или нейронов стриопаллидарной зоны ГМ при БП, когда количество погибших специализированных нейронов уже уменьшилось на треть и более. И если для ранней диагностики рака были найдены определенные ранние онкомаркеры заболевания, то для БАС, БА и БП их просто не существует, и в этой связи прогноз при диагнозе БАС звучит трагичнее прогноза при диагностике рака или других ЗНО. Определенные формы рака имеют шансы на излечение, а вот ALS, БП и БА нет. Аналогичная ситуация и при другом НДБ — болезни Альцгеймера (БА). Смерть при раке менее мучительна и сопровождается утратой сознания и комой на фоне раковой интоксикации, при БА — потерей разума, а смерть при БАС происходит при полном осознании происходящего от паралича дыхания при продолжающихся биениях сердца.
Почему мы столь не эффективны в диагностике и терапии этих БЦ? Ответ банален: мы не понимаем фундаментальных патогенетических молекулярно-биологических механизмов возникновения и течения данных заболеваний. При этом мы очень много знаем об общих молекулярных механизмах, происходящих в специализированных клетках при всех БЦ. ЗНО и НДБ объединяет системное накопление патологических белков в высокодифференцированных клетках-мишенях, вовлеченных в патологический процесс органов и тканей организма больного человека. При ЗНО это онкоспецифические белки (ОСБ), при НДБ это тау-белки, тельца Леви, SOD-1 белки и т. д. Но накопление патологических белков в клетках и в межклеточном пространстве — это не причина, а следствие патологического процесса. Называя БАС «болезнью моторного нейрона», мы игнорируем причину болезни и не даем больному шанса на излечение, так как существующая парадигма диагностики позволяет выявлять болезнь исключительно в ее финальной стадии. И это характерно как для ЗНО, так и для НДБ. Нужно найти общее системообразующее звено, запускающее эти болезни, и тогда мы научимся их своевременно диагностировать и излечивать. Как говорил Козьма Прутков: «Зри в корень»! Что является корнем каждой из этих смертельных болезней?
Роль иммунной системы в развитии рака, почти всех ЗНО и БАС, БА и БП и аутоиммунных заболеваний очевидна, и патология ГСК является общим системообразующим звеном при этих крайне полярных фатальных БЦ. Известно, что во всех случая этих смертельных заболеваний имеет место избирательная (селективная) функциональная недостаточность иммунной системы (НИС), которая играет важное значение в патогенезе и в патоморфологии этих заболеваний. Так, при большинстве запущенных форм рака и ЗНО с распространенными метастазами иммунная система пациента никак не реагирует на опухолевый рост и генерализацию опухолевого процесса, а также на наличие у больного первичных огромных опухолевых узлов и метастатических отсевов. Опухолевые клетки легко уклоняются от уничтожения собственными натуральными киллерами и макрофагами врожденного иммунитета и избегают смерти от цитотоксических Т-клеток приобретенного иммунитета, и эти механизмы подробно описаны учеными во всем мире. При этом при раке и всех ЗНО избирательно нарушается только противоопухолевая функция иммунитета, а все другие функции иммунитета (противомикробная, противовирусная, противогрибковая, борьба с простейшими и т. д.) практически не страдают. Иммунный статус у этих онкобольных соответствует показателям нормы или около нее. Аналогичная ситуация, но с противоположным знаком происходит с иммунной системой при таких НДБ, как БАС и БА и БП. Несмотря на то что долгое время часть НДБ считали аутоиммунными, существенных количественных изменений клеточного и гуморального иммунитета при БАС и БА не выявлено. Более того, последние годы аутоиммунный генез БАС неврологи во всем мире вообще стали считать необоснованным, так как нет эффекта от применения стандартной терапии, как при аутоиммунных заболеваниях: 1) нет достижения ремиссии болезни при введении глюкокортикоидных гормонов, 2) нет эффекта от аутологичной трансплантации костного мозга (ТКМ), как при рассеянном склерозе и других аутоиммунных болезнях соединительной ткани и 3) нет результата от применения блокаторов интерлейкинов и других препаратов, направленных на уменьшение системного воспаления и деструкции ткани. И эти аргументы стали определяющими в исключении аутоиммунного генеза у большинства НДБ. Очень часто методологические ошибки и непонимание генеза системности процесса возникновения и динамики БЦ являются причиной врачебных неудач.
Однотипность и нозоспецифическая полярность иммунологических реакций организма при этих БЦ позволяет предположить, что у них имеет место схожесть патогенетических механизмов их развития с определенными вариациями и особенности их морфологического дефекта в клетках иммунной системы. Сравнивая, например, рак и БАС, становится ясно, что эти заболевания имеют в своей основе доказанный мультигенетический дефект, статистически достоверные эпигенетические, транскриптомные и протеомные нарушения, что позволило нам заподозрить, что в основе их молекулярно-биологического дефекта лежит разновекторное повреждение генома и протеома ГСК как родоначальницы всех клеток систем кроветворения и иммунитета. ГСК или стволовые кроветворные клетки — очень малочисленная, но гетерогенная клеточная популяция, объединяющая в себе несколько типов (субпопуляций) клеток, отличающихся по уровням дифференцировки и способности к пролиферации. Среди них присутствуют как недифференцированные, практически не делящиеся стволовые клетки (СК), так и коммитированные (ограниченные в направлении дифференцировки) клетки-предшественники. Концентрация стволовых клеток (СК) в периферической крови в состоянии стабильного кроветворения мала — менее 0,01%, что делает затруднительным их изучение даже самыми чувствительными методами (Гривцова Л. Ю., Тупицын Н. Н., 2017). Но именно ГСК имеют самый большой клеточный цикл (360 дней) среди всех клеток организма человека (Белушкина Н. Н., Хомяков А. В., 2009), являются основной регуляторной и управляющей системой в существующей иерархии всех клеточных систем организма, первые реагируют на мутации генов в клетках и появление асептического воспаления в патологических тканях и органах, мигрируют из костного мозга в очаг повреждения ткани, ориентируясь на градиент концентрации воспаления, адгезируют к патологическим клеткам и «направляют их развитие» в сторону дифференцировки или апоптоза по механизму bystander effect. ГСК в зоне воспаления осуществляют горизонтальный и вертикальный информационный обмен цитоплазматическими белками с патологическими клетками. В зависимости от степени повреждения клеток-мишеней в тканях ГСК происходит эпигеномное и протеомное повреждение ГСК и формирование из них опухолевых стволовых клеток (ОСК) или клеток, получивших иммунизацию патоспецифическими белками, что мы показали в своих исследованиях по геномике и протеомике СК.
Поэтому целью настоящего исследования стало прицельное изучение геномных характеристик и выявление мутаций генов клональности в полном экзоме 22 000 генов клеток крови и ГСК костного мозга, а также изучение протеомных маркеров клеточной поверхности ГСК как диагностических факторов, подтверждающих наличие клонального гемопоэза у пациентов при таких смертельных заболеваниях, как рак, другие ЗНО и БАС (как модель НДБ), для выявления уникальных иммуноспецифических характеристик молекулярного ландшафта клеточной поверхности ГСК как фундаментальных молекулярно-биологических маркеров для ранней диагностики этих неизлечимых заболеваний.
У каждого обследуемого онкологического больного или больного с нейродегенеративными заболеваниями, аутоиммунными и наследственными болезнями под местной анестезией 0,5—1-процентного раствора новокаина или лидокаина забирали путем тонкоигольной пункции грудины (стернальная пункция) или пункции подвздошной кости, эксфузировали 2—3 мл костного мозга или брали 2—3 мл лейкоконцентрата мобилизованных мононуклеаров периферической крови, полученных после стандартной процедуры лейкоцитофереза после мобилизации ГСК в периферическую кровь с применением гранулоцитарного (Г-КСФ) или гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ). Также у каждого из этих пациентов мы забирали две пробирки по 3 мл периферической крови. Для проведения геномного исследования для изучения наличия клональноcти гемопоэза с неопределенным потенциалом (CHIP) мы пробирку с костным мозгом пациента и пробирку с его периферической кровью направляли в генетическую лабораторию МНИОИ им. А. П. Герцена — филиал ФГБУ НМИЦ радиологии Минздрава России для проведения секвенирования полного экзома 22 000 генов в ГСК человека, выделенных путем иммуносортинга на сортере CliniMACS (Германия) на магнитных шариках с антителами к CD34+ СD45+. Был произведен анализ ДНК клеток костного мозга методом секвенирования нового поколения (NGS).
Целевое парноконцевое секвенирование проводилось на приборе MGISEQ-G400 с использованием мультиплексной панели MGIEasy Exome Capture V5 с целью поиска герминальных мутаций в генах клональности: AKT, ASXL1, CBL, DNMT1, DNMT3A, DNMT3B, JAK2, MYD88, mTOR, Nanog, Oct-4, Pi3-K, PPM1D, PTEN, SF3B1, SOx2, TET, TP53.
Биоинформатическая обработка данных проводилась с использованием программ для демультиплексирования, картирования (BOWTIE2 v 2.2.5), определения вариантов (GATK 3.8—0) и аннотирования (SNPEff 4.3T Annovar 2017J) и других инструментов. Оценка риска патогенности выполнялась согласно рекомендациям ACMG (SF v2.0) /МГНЦ, включающая критерии: низкой популяционной частоты (частота варианта 1000 genomes и/или EXAC <0,01), повреждающий эффект (nonsense, frameshift), наличие информации о варианте в локус-специфических базах данных и др.
Часть эксфузата (биоптата) костного мозга передавали в иммунологическую лабораторию и там с использованием стандартных антител (таблица 1) на многоцветном проточном цитофлюориметре типа FaxCan исследовали экспрессию 22 стандартных белковых мембранных маркеров ГСК (CD34+ CD45+ HLA DR+). На основании проведенного цитофлюориметрического анализа описывали и профилировали состояние экспрессии основных маркеров клеточной поверхности (CD38, CD71, CD90, CD56, CD19, CD61, CD 117, СD10 и CD2) ГСК у исследуемых. При наличии герминогенных мутаций генов клональности в крови и КМ и совпадении полученного профиля мембранных белков ГСК по 6—9 основным параметрам экспрессии мембранных маркеров ГСК делали вывод о наличии у больного протеомных характеристик клонального гемопоэза, формирующего текущий онкологический процесс, а также о наличии хронической несостоятельности (недостаточности) противоопухолевой функции иммунной системы, и определяли прямые показания к иммунотерапии. При наличии клинических и нейрофизиологических признаков БАС у больного и наличии герминогенных мутаций генов клональности в крови и КМ и совпадении полученного профиля мембранных белков ГСК по 6—9 основным параметрам с нейроспецифическим профилем экспрессии мембранных маркеров ГСК делали вывод о наличии у больного нейроспецифического клонального гемопоэза БММП ГСК. При этом мы картировали, профилировали и описывали нейроспецифические молекулярно-биологические изменения профиля мембранных белков и трактовали полученные нарушения БММП ГСК как нейроспецифический профиль молекулярного ландшафта клеточной поверхности ГСК при БАС.
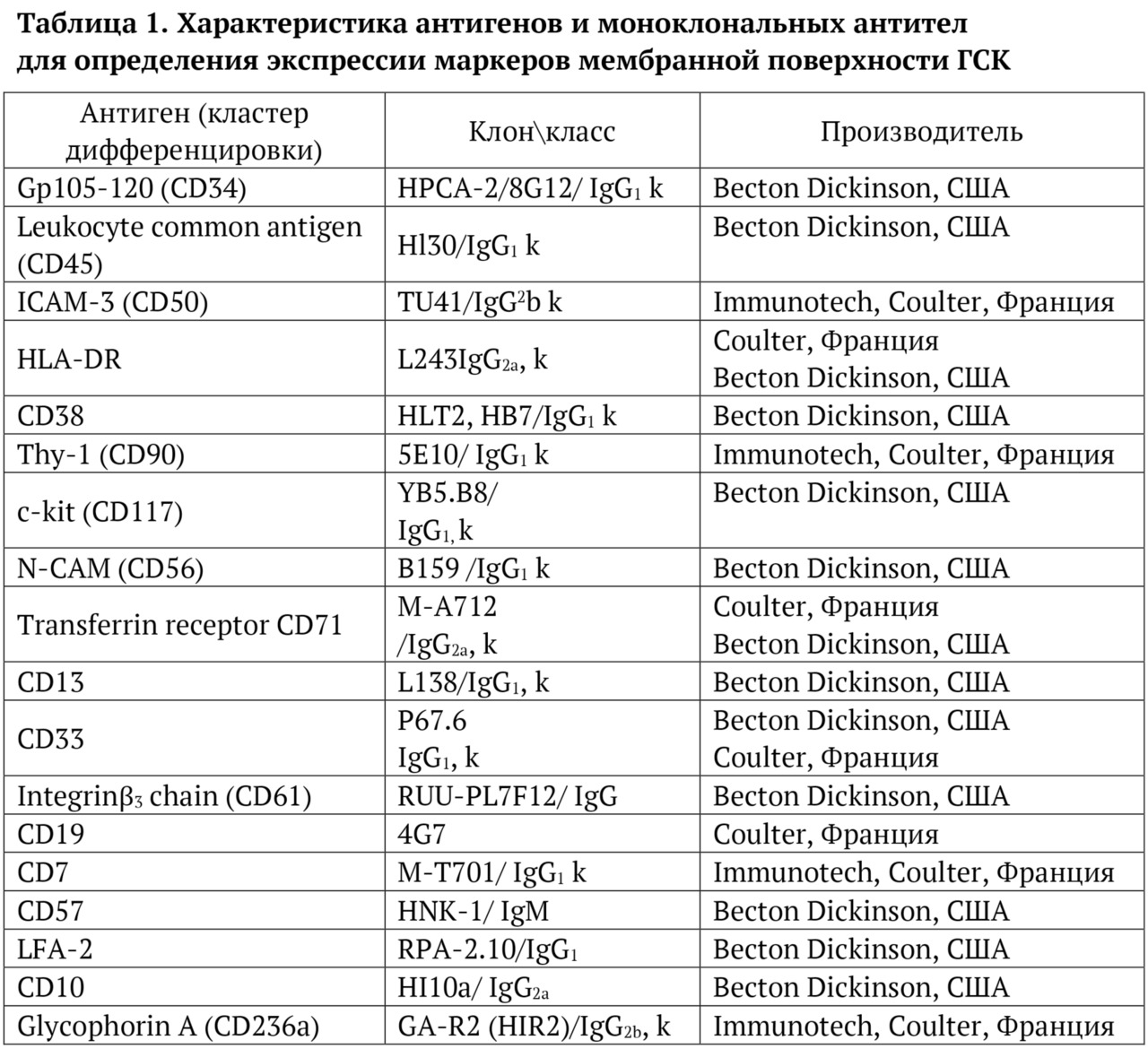
Результаты генетического изучения наличия клонального гемопоэза в ГСК костного мозга и мононуклеарах периферической крови у 108 пациентов с различными БЦ (35 человек со злокачественными солидными новообразованиями — колоректальный рак, нейроэндокринный рак кишечника, рак молочной железы, рак легкого, мультиформная глиобластома, меланома и др., 27 пациентов с аутоиммунными болезнями — сахарный диабет 1-го типа, аутоиммунный тиреоидит, ревматоидный артрит, СКВ и др., 26 больных с нейродегенеративными заболеваниями — БАС, системная нейродегенерация головного мозга, болезнь Паркинсона, болезнь Альцгеймера и др. и 20 больных с наследственными заболеваниями — болезнь Шарко — Мари — Тута, альфа-талассемия, синдром Смита — Лемли — Опица и др.) показали наличие клональности гемопоэза в 97,6% случаях с раширением не менее 4% от общей массы клеток циркулирующей крови в организме человека.
Для примера проиллюстрируем наличие клональности гемопоэза у различных пациентов с БЦ. Вот, например, как выглядят мутации генов клональности у больного К., 67 лет, с нейроэндокринным раком кишечника с метастазами в печень (таблица 2).
Список выявленных герминальных мутаций генов клональности гемопоэза у больной И. В. К-ва, 53 лет, с раком молочной железы (таблица 3).
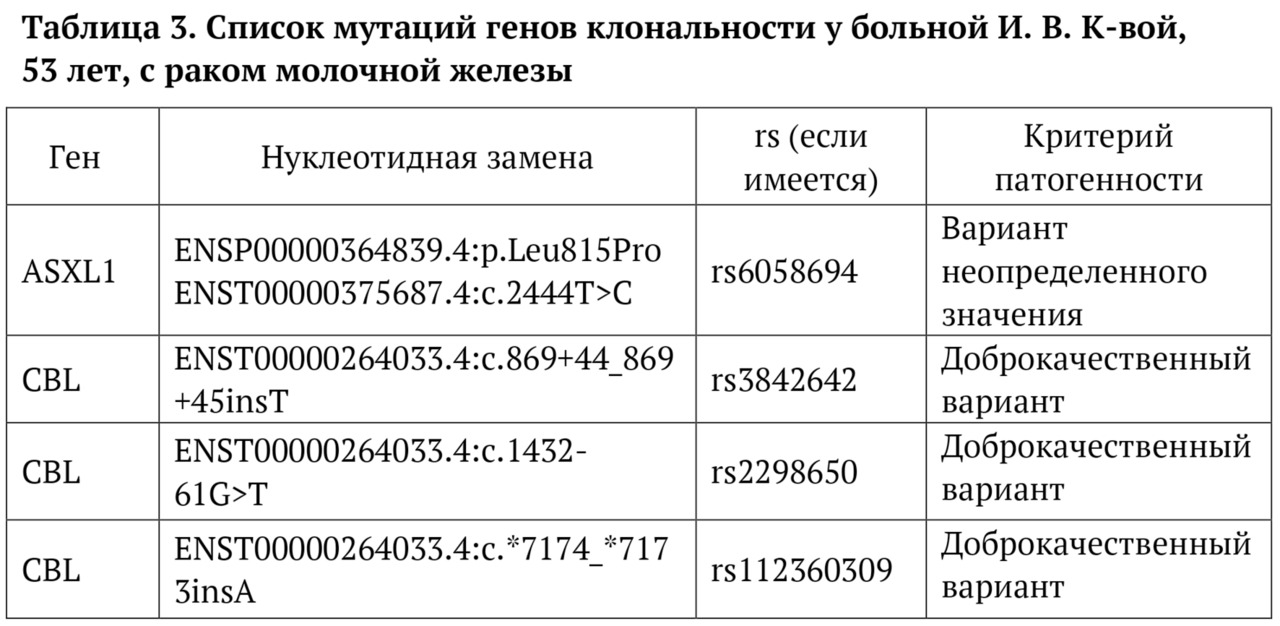
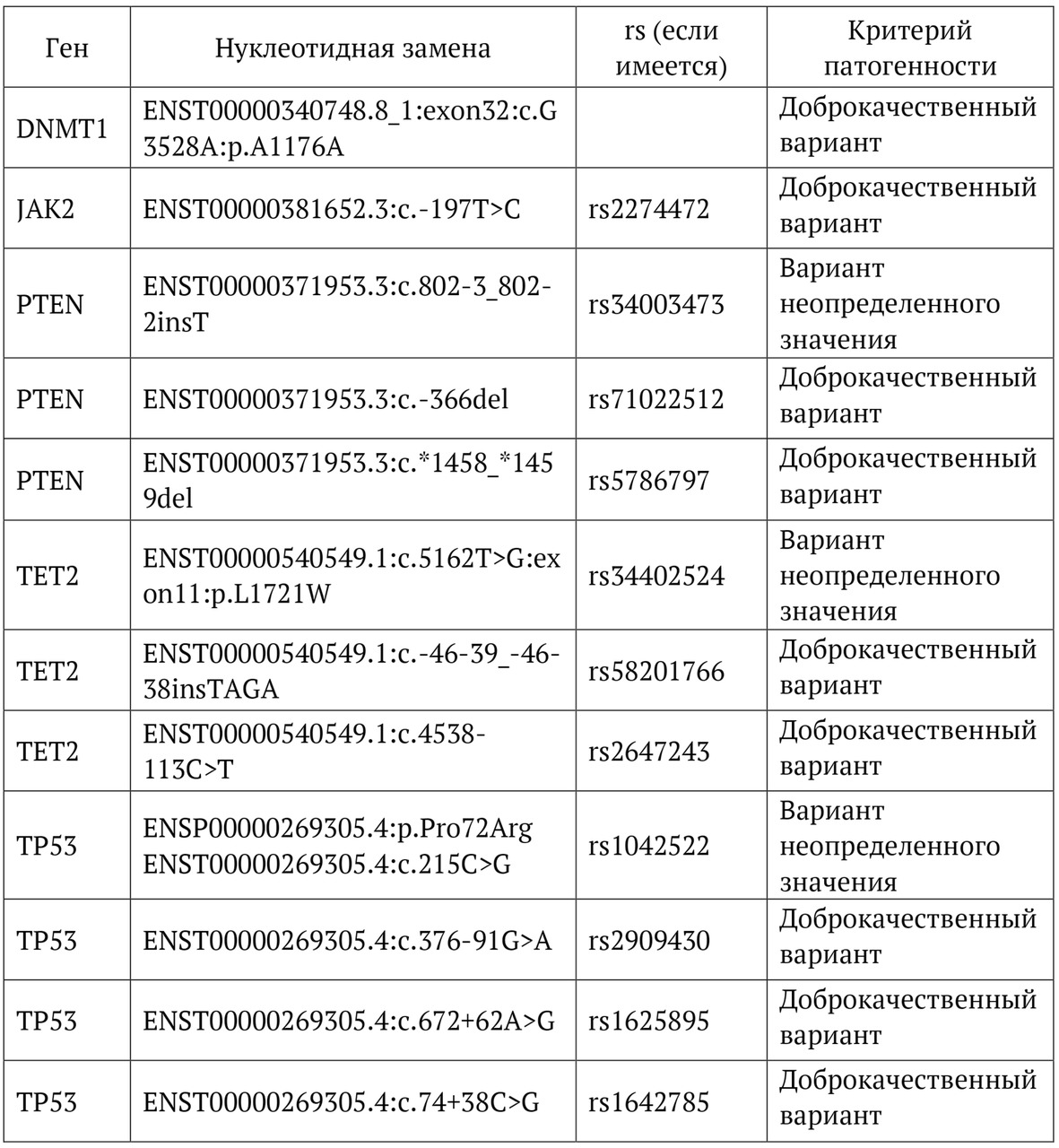
По мнению большинства специалистов в области клональности гемопоэза, пока никто и никогда не выявлял при нейродегенеративных болезнях головного и спинного мозга явлений клонального кроветворения (Jaiswal S., 2020). Иллюстрацией наличия клонального гемопоэза при нейродегенеративных болезнях могут быть ниже представленные клинические примеры.
Герминогенные мутации были выявлены у пациента И. А. Л-ко, 30 лет (таблица 4), с подтвержденным диагнозом бокового амиотрофического склероза (БАС).
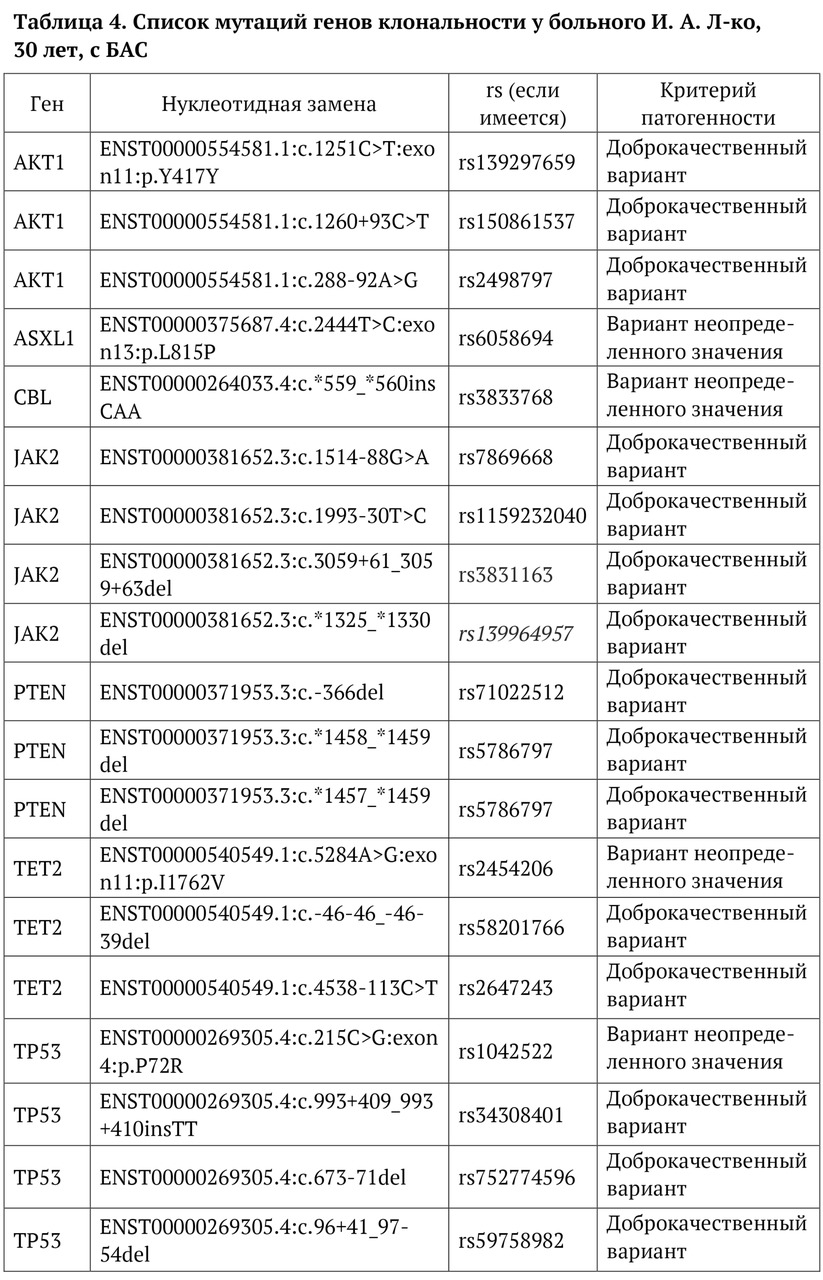
А вот в таблице 5 представлен спектр соматических мутаций в генах клональности костного мозга и периферической крови при наследственной болезни Паркинсона у больной Е. В. Ф-ковой, 55 лет.
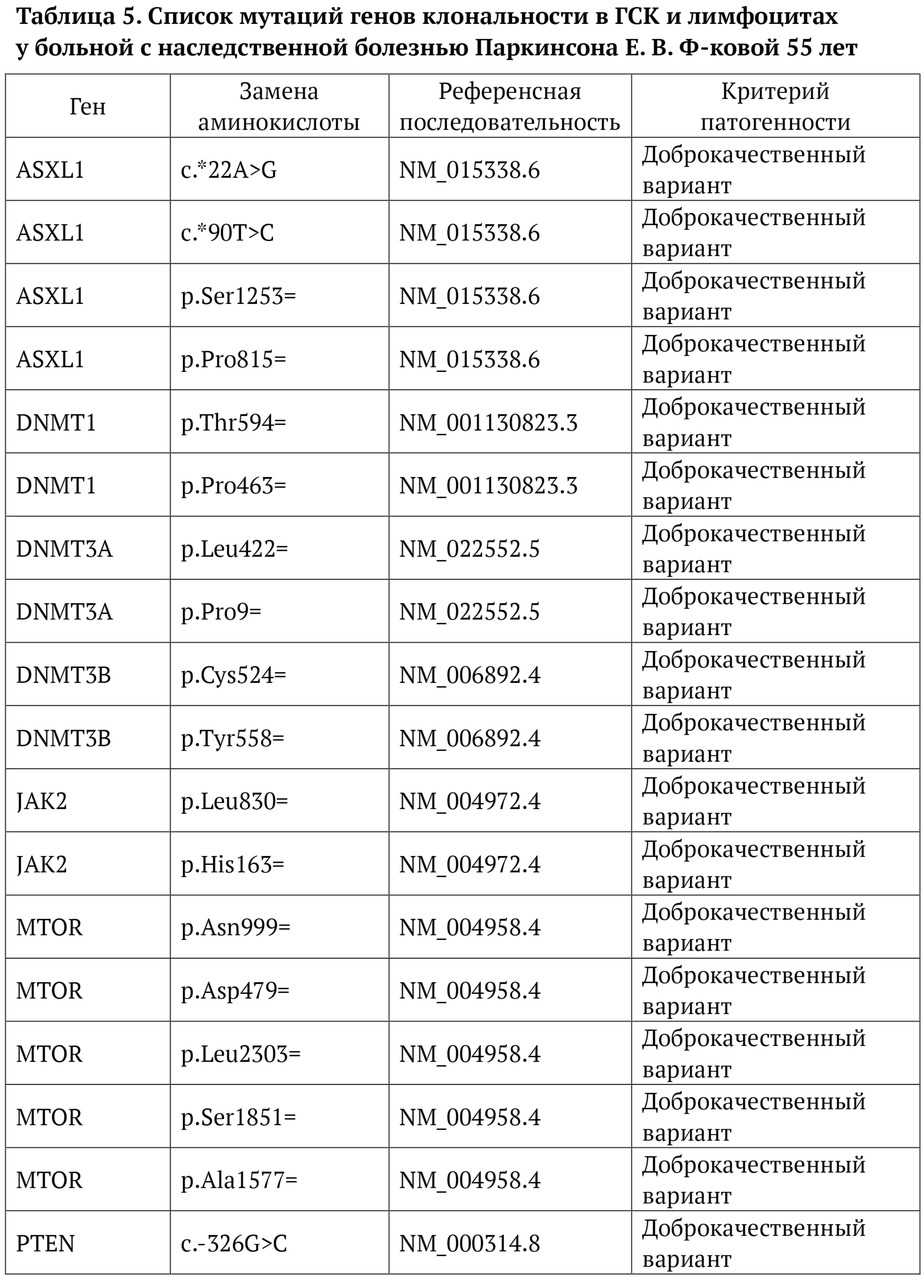
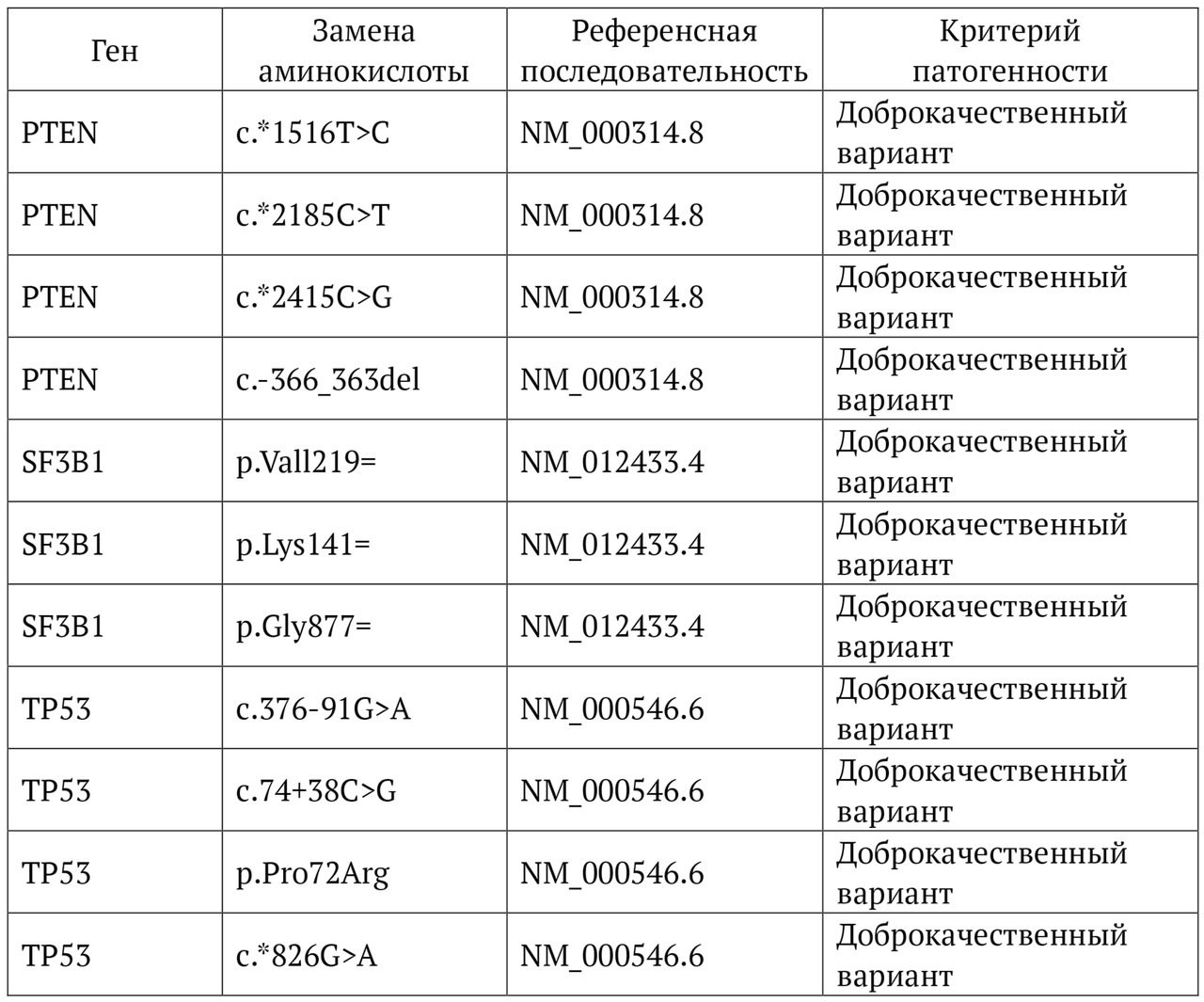
А вот так выглядит спектр мутаций генов клональности при наличии клонального гемопоэза у больного В. П. Гор-ва, 74 лет, с системным нейродегенеративным заболеванием головного мозга (таблица 6).
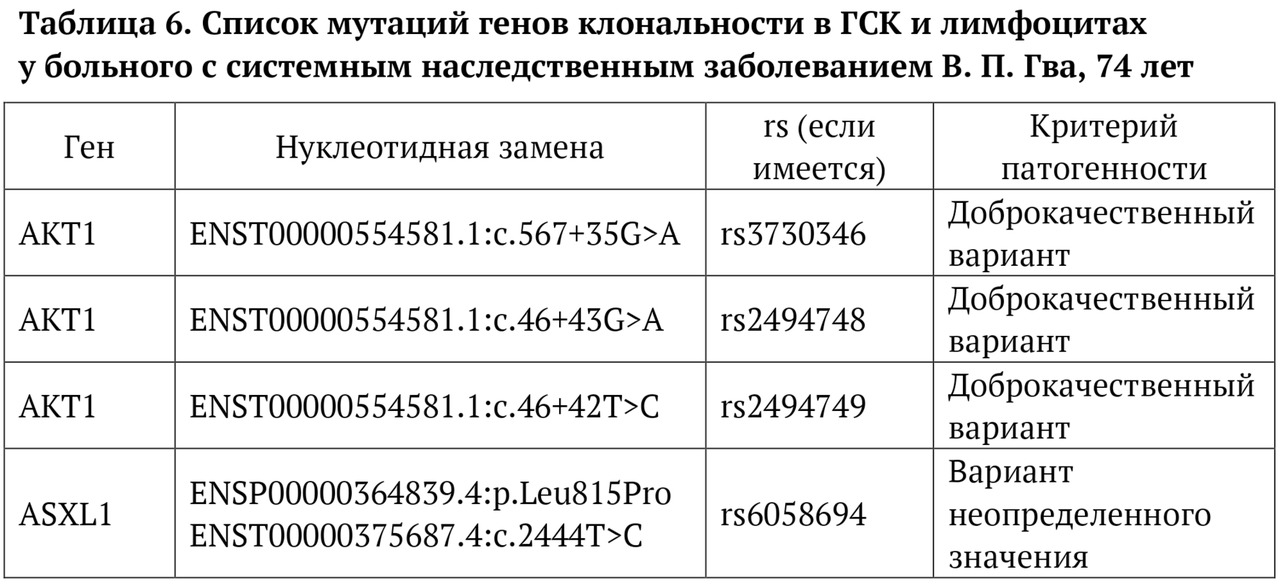
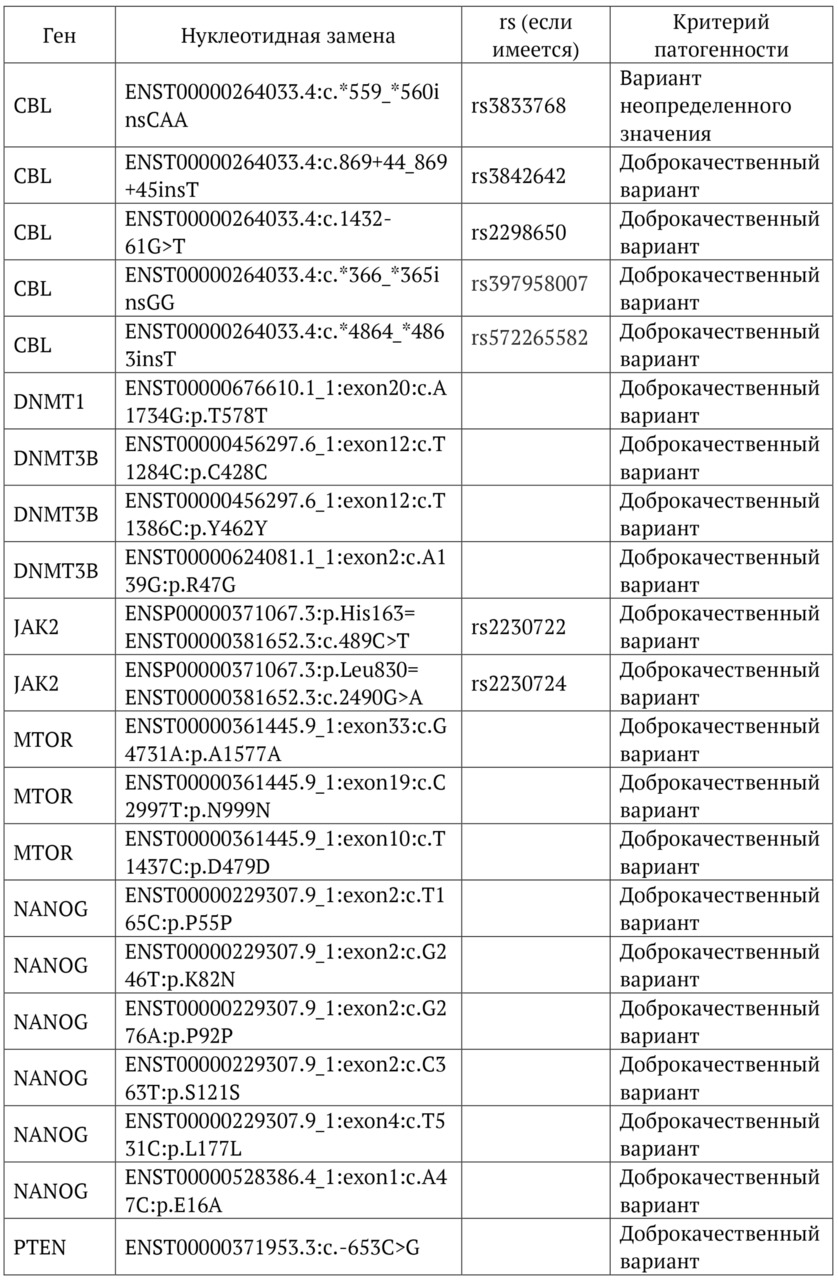
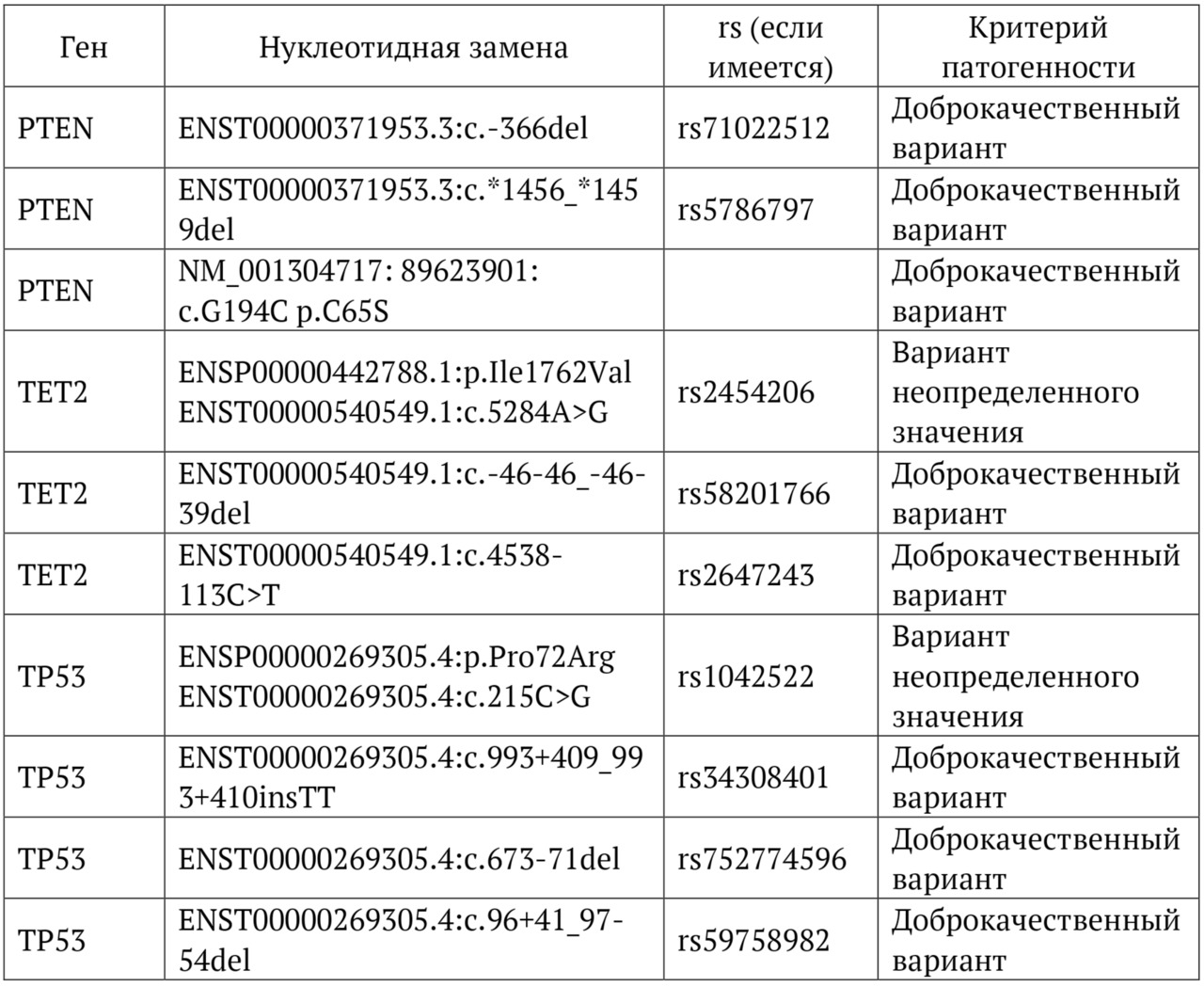
Действительно, до настоящего времени в доступной нам литературе мы не находили сведений о наличии клонального гемопоэза у больных с нейродегенеративными заболеваниями. Как показали наши исследования, у пациентов с НДБ в большинстве случаев отмечался спорадический клональный гемопоэз (КГ), который чаще всего связан с мутациями в DNMT3B, TET2, ASXL1, выявленными у данных пациентов. Лишь у трех пациентов с НДБ был выявлен наследуемый характер нейродегенеративного заболевания, подтвержденный патологическими полиморфизмами, выявленными при исследовании полного экзома человека. Мутация гена ASXL1 у этих пациентов свидетельствует о нарушении способности к самообновлению их ГСК. Как правило, у пациентов со спорадической формой НДБ было не менее одной мутации гена AKT1, являющегося внутриклеточным ферментом, одним из трех членов семейства протеинкиназ B. А вот у пациентов с наследственной формой НДБ этих мутаций не отмечено. Киназа AKT1 является ключевым ферментом сигнального пути PI3K/AKT и вовлечена в регуляцию пролиферации, роста и выживания клеток.. АКТ1 выступает в роли онкогена при многих злокачественных заболеваниях. Две и более мутации гена JAK2, выявленные у пациентов с НДБ, являются любопытной мутацией клонального гемопоэза (КГ), который можно найти примерно у 3% людей с КГ. Этот вариант является практически единственной мутацией в активирующей сигнальной молекуле при КГ. Мутация JAK2 часто встречается в миелопролиферативных новообразованиях, где она часто является единственной драйверной мутацией, которую можно идентифицировать у этих пациентов. Уже один этот факт указывает на нечто особенное в этой сигнальной мутации гемопоэза. Их наличие у всех пациентов с НДБ тоже может иметь драматический характер. Первоначально мышиные модели предположили, что JAK2-мутантные ГСК имеют скромное конкурентное преимущество. Однако более количественный анализ отдельных клеток показывает, что JAK2 уменьшает самообновление отдельных ГСК, но приводит к экспансии клеток-предшественников, что обеспечивает окно, в котором могут накапливаться коллаборативные мутации, приводящие к прогрессированию заболевания. Мы пришли к выводу, что мутации в гене JAK2 в ГСК являются драйверными мутациями, обусловливающими прогрессирование НДБ. Наличие мутаций гена MTOR свидетельствует о нарушении в синтезе белка, в обмене глюкозы, инсулина и липидов, в метаболизме глутамина. Является важным регулятором возникновения множества неврологических и иммунных процессов. Хотя ген NANОG не относят к обязательным генам клональности, большее количество мутаций (до шести мутаций гена NANОG, являющегося гомеобоксным транскрипционным фактором) лежит в основе нарушения плюрипотентности. «Выключение» этого гена приводит к запуску дифференцировки СК. Первооткрыватель этого фактора шотландец Ian Chambers так говорит об истории его наименования: «Похоже, Nanog — один из основных генов, определяющих возможности стволовых клеток по неограниченному росту в лаборатории и в организме. Такое количество мутаций позволяет утверждать о повреждении возможностей к неограниченному росту ГСК. Мы обратили внимание на наличие не менее трех мутаций гена DNMT3A, кодирующего фермент ДНК-метилтрансферазу de novo, ответственный за установление новых паттернов метилирования ДНК во время развития при НДБ. Эти мутации свидетельствуют о нарушении принятия решений о судьбе стволовых клеток. Клетки крови, несущие мутации в гене DNMT3А, способны вызывать более сильный иммунный ответ как против нормальных тканей хозяина, так и против опухоли. Мутации в эпигенетических регуляторах, таких как DNMT3A и TET2, дают преимущество, усиливая самообновление стволовых клеток и клеток-предшественников и ингибируя их дифференцировку. Мутации в эпигенетических регуляторах доминируют в ландшафте КГ, при этом около 50% всех мутаций КГ являются вариантами DNMT3A. Большинство мутаций DNMT3A при КГ являются гетерозиготными и, вероятно, приводят к потере функции белка по разным механизмам. Мутации DNMT3A при КГ распространяются по всей длине гена, при этом миссенс-мутации группируются в известных структурных и функциональных доменах. Важно отметить, что спектр вариантов DNMT3A при КГ отличается от наблюдаемого в миелоидных новообразованиях, поскольку он заметно менее обогащен остатком горячей точки R882. Уровень активности DNMT3A, остающийся после мутации, фактически «дозировка» DNMT3A, будет коррелировать со скоростью размножения мутантных клонов. У пациентов с НДБ были обнаружены частые соматические мутации в TP53. Гены TP53 являются центральными эффекторами реакции на повреждение ДНК, вызванной незащищенными концами теломер, что повышает вероятность того, что истощение теломер в популяции ГСК отбирает клетки с генетической способностью избегать путей старения без необходимости репарации лежащих в основе дефектов удлинения теломер. Соматические мутации ТР53 опосредуют миелоидную трансформацию при СШД. В исследовании SDS Registry наличие, количество и распространенность аллелей соматического TP53 не были предикторами неминуемого риска лейпикемии у пациентов с СШД. Вместо этого прогрессирование мутантных по TP53 клонов было опосредовано развитием биаллельных изменений в локусе TP53, делецией, потерей гетерозиготности с нейтральной копией или второй точечной мутацией. В функциональных экспериментах было показано, что инактивация TP53 повышает конкурентоспособность SBDS-дефицитных клеток за счет инактивации путей старения без коррекции лежащих в основе SDS рибосом и дефектов трансляции. В соответствии с этими генетическими наблюдениями человека потеря TP53 может разъединить рибосомный стресс, вызванный дефицитом SBDS, от активации путей клеточного старения, что приводит к частичному восстановлению фенотипа СШД. Инактивация TP53 ограничивает клеточные последствия неэффективности трансляции и дефектной длины теломер, соответственно указывая на то, что активация пути p53 ограничивает относительную приспособленность и опосредует устранение «неудачников». Таким образом, инактивация TP53 в одиночных клонах ГСК может превратить «проигравших» в «победителей», что согласуется с наблюдаемым рецидивом соматических мутаций TP53 при CHIP и миелоидных новообразованиях, возникающих при SDS и нарушениях биологии теломер. У пяти пациентов с НДБ мы нашли по 3—5 мутаций гена PTEN, что означает наличие заболевания, называемого синдромом Коудена. Синдром Коудена повышает риск развития определенных видов рака (рак молочной железы; рак матки (эндометрия); рак щитовидной железы; колоректальный рак (рак толстой и прямой кишки) и образование полипов в толстой кишке; рак почек). Мутации гена PTEN увеличивают риск развития других типов рака. Мы отметили у большей трети пациентов наличие 1—5 мутаций гена CBL млекопитающих, кодирующий белок CBL, который представляет собой убиквитин-протеиновую лигазу E3, участвующую в передаче клеточных сигналов и убиквитинировании белка. Мутации в этом гене были вовлечены в ряд раковых заболеваний человека, особенно в острый миелоидный лейкоз. При этом данных на наличие лейкоза не было выявлено ни на уровне полиморфизмов генома, ни клиническими данными.
Очевидно, что существует масса возражений со стороны фундаментальной академической науки, которая с большой осторожностью относится к категоричным выводам о наличии «клонального гемопоэза с неопределенным потенциалом» (CHIP) и связи этого феномена с конкретными болезнями цивилизации. Как утверждает Siddhartha Jaiswal из Стэнфордского университета (США) в своей статье «Clonal hematopoiesis and nonhematologic disorders», опубликованной в октябрьском номере журнала Blood (2020, doi: 10.1182/blood.2019000989), в ближайшие годы ожидается, что более 1 млн человек пройдут секвенирование ДНК цельной крови в рамках крупных исследований биобанков. Тысячи других будут оцениваться на CHIP в одноцентровых исследованиях. Поскольку эта область развивается, поддержание строгих стандартов для оценки ассоциаций между CHIP и различными фенотипами будет иметь решающее значение. Во-первых, исследователи должны будут тщательно рассмотреть когорты, отобранные для анализа таких данных. Можно использовать либо популяционные когорты, не отобранные для интересующего заболевания, либо вложенные исследования «случай — контроль» внутри таких когорт. В идеале лица, не имевшие заболевания на исходном уровне, должны находиться под длительным наблюдением на предмет развития заболевания после взятия образца ДНК для скрининга CHIP. Следует использовать анализ времени до события, такой как модели пропорциональных рисков Кокса, и сообщать о величине эффекта после поправки на известные искажающие факторы. Использование ретроспективных когорт, в которых заболевание возникло до времени взятия образца ДНК, неоптимально из-за нескольких предубеждений. Во-первых, временная связь между болезнью и клоном CHIP не может быть установлена, что исключает выводы о причине и следствии. Эти исследования могут также маскировать истинный эффект, если большая часть случаев распространенного заболевания произошла в далеком прошлом до развития CHIP. Наконец, ретроспективный анализ может привести к систематической ошибке, связанной с выживанием; у носителей CHIP может быть больше шансов умереть или заболеть, что препятствует их включению в такие ретроспективные исследования. Во-вторых, должны быть добросовестные усилия, чтобы избежать сообщений о ложноположительных или отрицательных выводах. Siddhartha Jaiswal (2020) предлагает исследователям выполнить расчет мощности, чтобы определить, достаточно ли велико их исследование для надежного обнаружения предполагаемых ассоциаций, прежде чем сообщать о результатах такого анализа. Любые положительные ассоциации в 1-й когорте или исследовании должны быть воспроизведены в независимой когорте, что является стандартом, принятым более широким генетическим сообществом. Если в одном и том же исследовании оцениваются несколько фенотипов, следует провести коррекцию нескольких гипотез. Отсутствие статистической значимости в одном исследовании не позволяет ученому сделать вывод об отсутствии связи. Если эти нормы не соблюдаются, то, в-третьих, должны быть приняты последовательные стандарты для анализов и интерпретации вариантов. CHIP был обнаружен с помощью секвенирования всего генома, секвенирования всего экзома, стандартного целевого секвенирования и целевого секвенирования с исправлением ошибок. Распределение VAF сильно зависит от конкретного подхода к секвенированию, что сильно влияет на наблюдаемую распространенность клонального кроветворения. Таким образом, определение последовательности случаев и контролей в исследовании с использованием одних и тех же технологий имеет решающее значение, и следует избегать использования исторических контролей или сравнения с ранее опубликованными исследованиями. Даже при использовании одного и того же анализа «клональный гемопоэз» может быть определен разными исследователями по-разному. CHIP имеет очень конкретное определение, поэтому Siddhartha Jaiswal (2020) предлагает, чтобы это определение (или другой четко определенный объект) использовалось по умолчанию для таких исследований. В большинстве исследований люди классифицировались как имеющие клональное кроветворение только в том случае, если они несли ассоциированный с раком соматический вариант, как сообщалось в литературе или в Каталоге соматических мутаций при раке (COSMIC); все остальные варианты должны быть классифицированы как «варианты неизвестной значимости» и проанализированы отдельно. Если позволяют цифры, следует также изучить специфические для генов эффекты. Когда рассматриваются варианты, не соответствующие определению CHIP, американские исследователи предлагают исследователям включать такие варианты в отдельные анализы.
Невозможность сопоставления результатов наличия мутаций в различных генах клональности с клиническими проявлениями болезни заставила нас пристальнее присмотреться к исследованию протеома ГСК, и это дало свои положительные результаты. Повторим аксиому, сформулированную академиком А. И. Арчаковым еще в начале 2000-х годов на одной из своих лекций по протеомике клеток: «Геном — это эскиз, транскриптом — это чертеж, а протеом есть готовое изделие». То, что имеет место неопределенность на уровне генома клетки и определяется как CHIP c неопределенным потенциалом, на уровне протеома клетки уже представляется с достаточно понятным и определенным патоспецифическим (онкоспецифическим, нейроспецифическим, аутоиммуноспецифическим и др.) потенциалом. Поэтому геномные данные о наличии CHIP, дополненные протеомными данными по молекулярно-биологической структуре ГСК, позволят представить проблему клонального гемопоэза более объемно и всесторонне. Поэтому для каждого больного, прошедшего генетическое тестирование на наличие CHIP, было проделано протеомное картирование и профилирование антигенов мембранной поверхности ГСК.
Почему мы решили базировать свои протеомные данные на результатах иммунофенотипирования мембранных антигенов ГСК? Ответ на этот вопрос мы дали в своих предыдущих работах по онкопротеомике ГСК при различных типах ЗНО, которые были опубликованы в двух монографиях на русском и английском языке (Брюховецкий А. С., 2014; Bryukhovetskiy A. S., 2015), и в целой серии публикаций в отечественных и зарубежных научных журналах (Брюховецкий А. С., Гривцова Л. Ю., 2020), и даже в диссертации на соискание степени доктора медицинских наук И. С. Брюховецкого (2018).
Исследование протеомики мембранной поверхности субпопуляций стволовых кроветворных клеток было проведено на 569 образцах кроветворной ткани (клетки крови и клетки лейкаферезного продукта-ЛП) у 167 онкологических больных взрослого возраста и на 557 образцах кроветворной ткани у 263 больных онкопедиатрической клиники. В исследование включен 61 образец ЛП 50 взрослых доноров аллогенной кроветворной ткани для 47 реципиентов (дети с онкогематологической патологией) и на 66 образцах у 60 пациентов с ALS. Все больные получали лечение и наблюдались в отделениях трансплантации костного мозга онкогематологии и онкологии ФГБУ НМИНЦ онкологии им. Н. Н. Блохина Минздрава России и в клинике «НейроВита» в период с 1996 года по 2020 год.
Проанализировано 179 образцов периферической крови (ПК) и 390 образцов мононуклеарной фракции клеток крови (лейкаферезный продукт, ЛП), полученных в ходе процедуры сепарации периферической крови на сепараторах крови (Baxter, Cobe Spectra и Optima Spectra).
Средний возраст взрослых онкологических больных составил 33 года (медиана 32 года, от 16 до 64 лет), вес пациентов варьировал от 43 до 113 кг. Среди пациентов преобладали мужчины — 113 человек, женщины — 54 человека (32,3%). Средний возраст пациентов с БАС составил 56 лет (медиана 54 года, от 42 до 68 лет). Среди пациентов с БАС доминировали мужчины (45 человек) над женщинами (15 человек). Средний вес пациентов с БАС составил 74 кг у мужчин и 56 кг у женщин.
В исследуемой группе взрослых преобладали больные с онкогематологической патологией (158 человек — 94,7% от общего числа больных): лимфома Ходжкина — 58 человек (34,7%), НХЛ (диффузная В-крупноклеточная лимфома и лимфомы из В-линейных предшественников, 2 пациента с лимфомой Беркитта) — 57 человек (34,1%). В исследование включены 40 больных (23,9%) множественной миеломой и 3 больных ОМЛ. Незначительную пропорцию составили больные с негемопоэтическими опухолями (всего 5,3% — 9 человек). Рак молочной железы — 3 больных, 2 больных мелкоклеточным раком легкого, 1 — негерминогенная опухоль яичек, 1 — герминогенная опухоль и 2 — саркомой Юинга.
Среди всех больных БАС 3 пациента страдали семейной формой БАС, у остальных 57 человек БАС был представлен спорадической формой. 13 больных БАС имели высокую (бульбарную) форму БАС. Одна пациентка за период наблюдения была переведена на аппарат ИВЛ, но в дальнейшем в течение 2 лет продолжила свое пребывание в исследовательской группе на искусственной вентиляции на аппарате ИВЛ.
Также в исследование были взяты трое больных с БА — две женщины и один мужчина. Средний возраст 72,6 года. Диагноз БА данным больным был установлен в психиатрическом стационаре. А также два пациента с болезнью Паркинсона (БП), сопровождающейся системной корковой атрофией: две женщины в возрасте 66 лет и 69 лет с акинетико-ригидной формой БП. Эти больные были взяты для дополнительной иллюстрации общей тенденции хронической нейродегенеративной иммунной недостаточности у пациентов с НДБ.
Во всех случаях для мобилизации ГСК у взрослых использован гранулоцитарный- колониестимулирующий фактор (Г-КСФ). Предлеченность у взрослых онкологических больных варьировала от 2 до 22 курсов химиотерапии. Химиотерапевтические режимы, предшествующие введению ростовых факторов, варьировали в зависимости от диагноза больного. Так, в случае лимфом Ходжкина и в нескольких случаях НХЛ использованы схемы DEXA-BEАM и BEACOPP. В ряде случаев В-клеточных лимфом у взрослых использованы схемы с ритуксимабом (R-CHOP). При лимфоме Ходжкина также в нескольких случаях применены схемы CHOP. При множественной миеломе назначению ростовых факторов предшествовала схема VAD, при раке молочной железы CAF.
Также были охарактеризованы ГСК 557 образцов стимулированной кроветворной ткани (115-ПК, 442-ЛП) у 263 детей (123 девочки и 140 мальчиков). 48 больных находились на лечении по поводу рецидивной или резистентной к предыдущей химиотерапии нейробластомы, у 41 — другие мягкотканые саркомы (рабдомиосаркома — 14, синовиальная саркома — 7 человек, 20 — ретинобластома высокого риска), 24 человека — ПНЕО, 63 — саркома Юинга высокого риска, у 22 — ОМЛ высокого риска, у 16 — лимфома Ходжкина, 6 — В-НХЛ, 11 больных — опухоли ЦНС (глиома, АТРО, эпиндимома), 28 больных медуллобластомой, 1 — метастатическая остеосаркома, 3 больных герминогенными опухолями. Средний возраст 7,88±0,28 лет (медиана 7 лет, от 0,6 до 19 лет), средний вес — 29,3±0,98 (медиана 23,0, от 7,0 до 87,0) кг. 95% лейкаферезов (420 из 442) проведены после мобилизационных режимов, включающих химиотерапию с последующим назначением одного из миелоцитокинов или их комбинации. Г-КСФ назначался у 259 больных, ГМ-КСФ — у 4 больных.
На момент начала лейкафереза (ЛФ) у всех больных был достигнут положительный ответ (полная или частичная ремиссия) со стороны первичной опухоли и/или метастазов и в пунктате костного мозга метастазы опухоли микроскопически не выявлялись.
Весь материал был статистически обработан с использованием пакета прикладных программ «Статистика-8».
В ходе исследования 1 253 образцов мононуклеарной фракции крови (лейкаферезные продукты, лейкоконцентраты), стимулированной периферической крови и эксфузатов костного мозга было проведено изучение мембраной экспрессии антигенов, ассоциированных со стволовой кроветворной клеткой различного уровня дифференцировки.
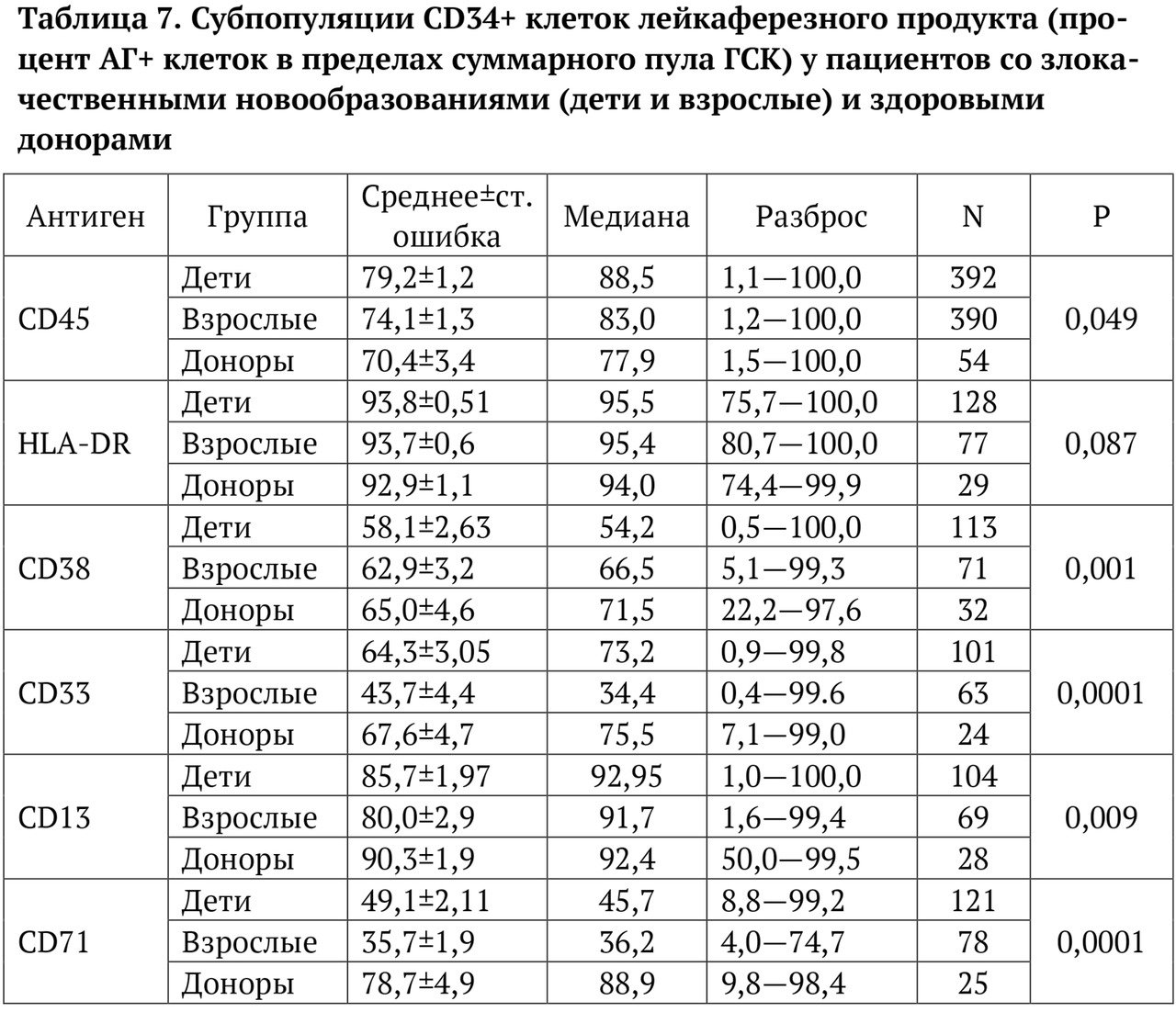
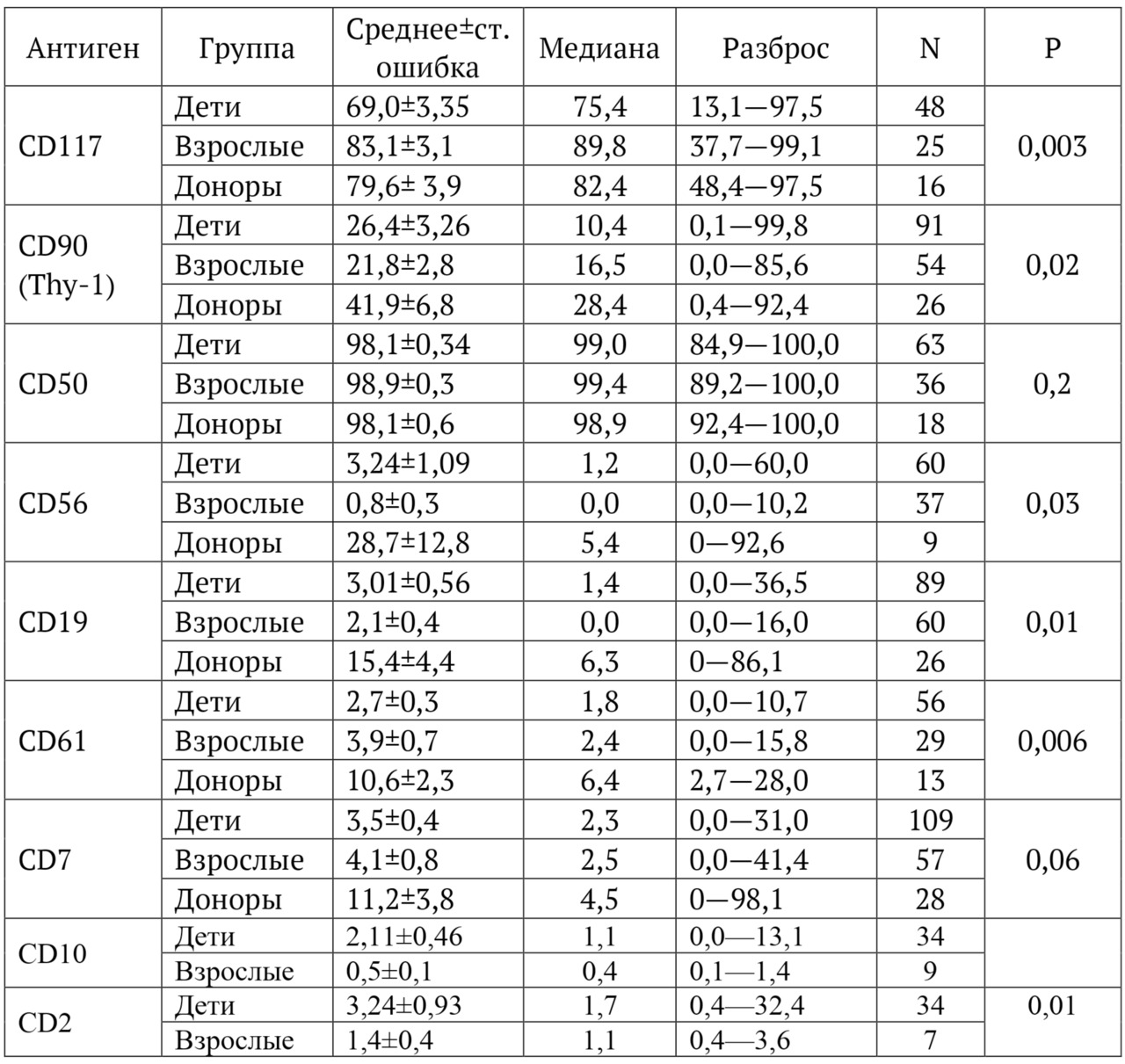
В таблице 7 представлены основные фундаментальные изменения экспрессии маркеров клеточной поверхности ГСК в 1 187 пробах онкологических больных и здоровых доноров. Эти же данные представлены в виде диаграммы (рисунок 1), которая наглядно иллюстрирует, что межклеточный информационный белковый взаимообмен между ОК и ГСК пациента очень серьезно и статистически достоверно изменяет протеомный состав экспрессирующих мембранных белков ГСК онкологических пациентов. Сравнительный анализ экспрессии маркеров клеточной поверхности ГСК у здоровых доноров и онкологических пациентов (взрослых и детей) демонстрирует выраженное снижение экспрессии целого ряда поверхностных белков клеточной поверхности (CD38, CD71, CD90, CD56, CD19, CD61) почти в два и более раза у взрослых онкологических больных. В то же время у этого контингента онкобольных на ГСК появляются высокая концентрация CD 117 и новые белковые маркеры клеточной поверхности (СD10 и CD2), которых в норме на поверхности ГСК здоровых людей никогда не обнаруживалось.
В таблице 8 представлены основные фундаментальные изменения экспрессии маркеров клеточной поверхности ГСК в 1 187 пробах онкологических больных, 54 пробах здоровых доноров и 66 пробах больных с БАС.
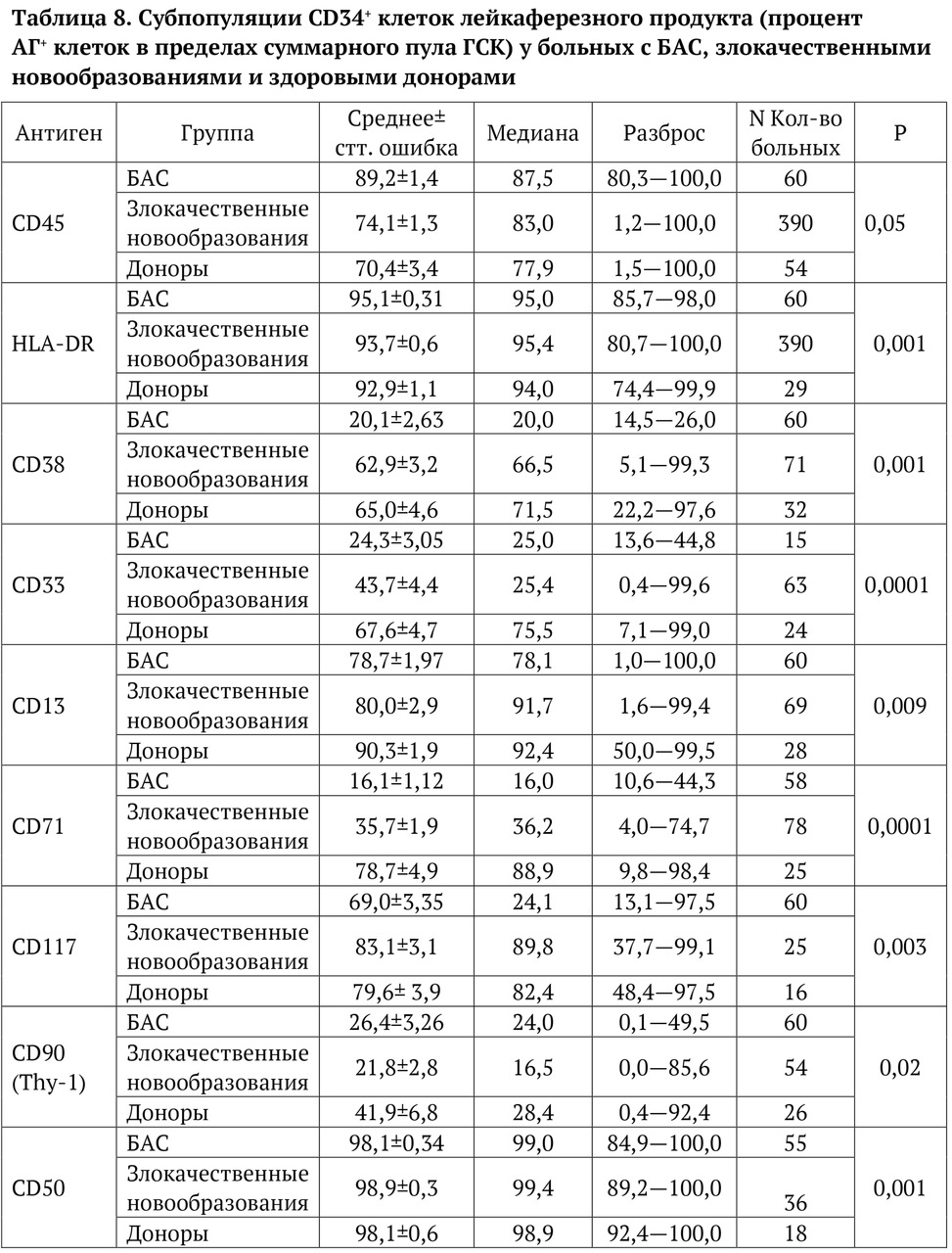
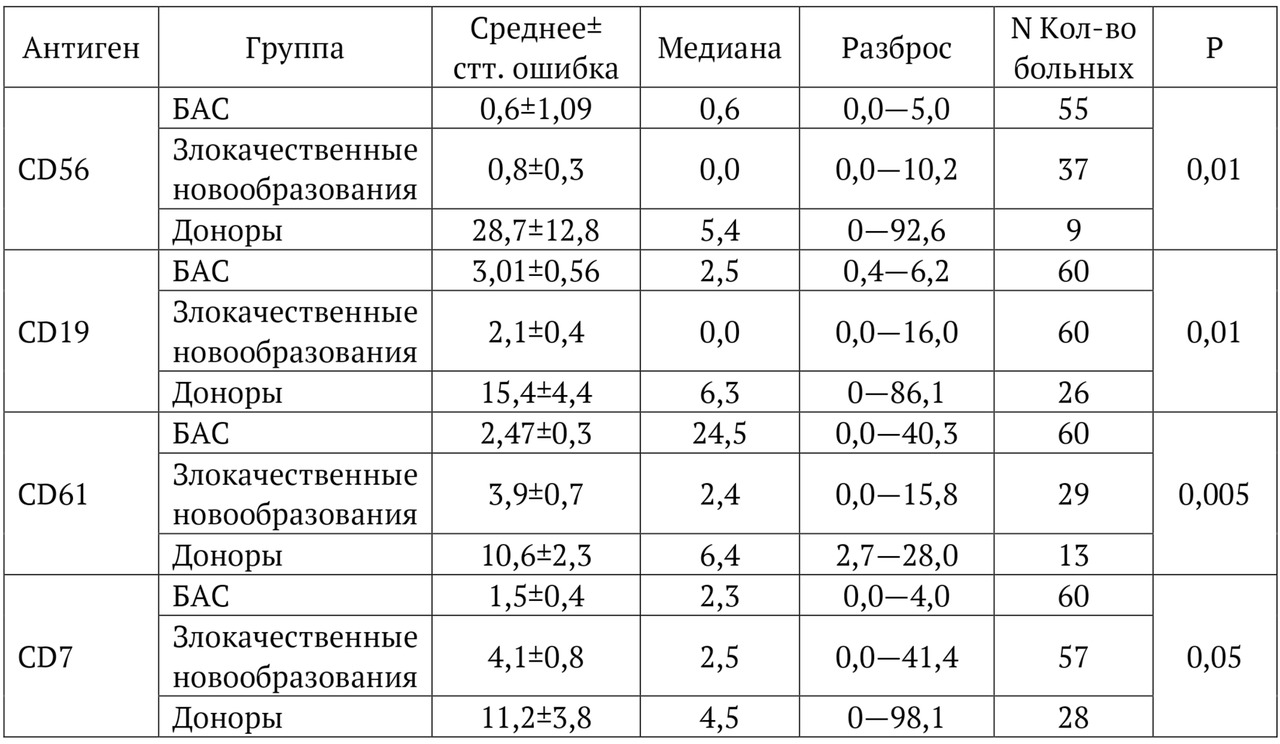
В то же время у детей с онкопатологией также на фоне общей тенденции снижения тех же белковых маркеров клеточной поверхности (CD38, CD71, CD90, СD117, CD56, CD19, CD61) и появления ранее не известных маркеров клеточной поверхности (CD2, CD10) отмечается отчетливое повышение концентрации маркера СD45. Онкоспецифический протеомный профиль клонального гемопоэза представлен на диаграммах (рисунок 6 и 7).
Как видно на диаграммах (рисунок 8, 9, 10), у всех больных БАС на поверхности клеточных мембран аутологичных ГСК больных практически отсутствует маркер CD38, а также резко снижены показатели CD117 и CD71, а у больных с онкологическими заболеваниями на поверхности ГСК отмечено значительное подавление маркера CD33 и маркеров СD71 и CD90 (Thy-1). БАС — это протеомное заболевание ГСК, где ее потомки — патологические иммунные клетки — вызывают локальное воспаление в боковых столбах спинного мозга и исходом этого воспаления является дегенеративный процесс. При онкологическом заболевании клетки иммунной системы не контролируют рост и пролиферацию опухолевых клеток и результатом является бесконтрольный опухолевый рост. И в том, и в другом случае очевидны нозоспецифические изменения профиля экспрессии мембранных маркеров ГСК у этих больных.
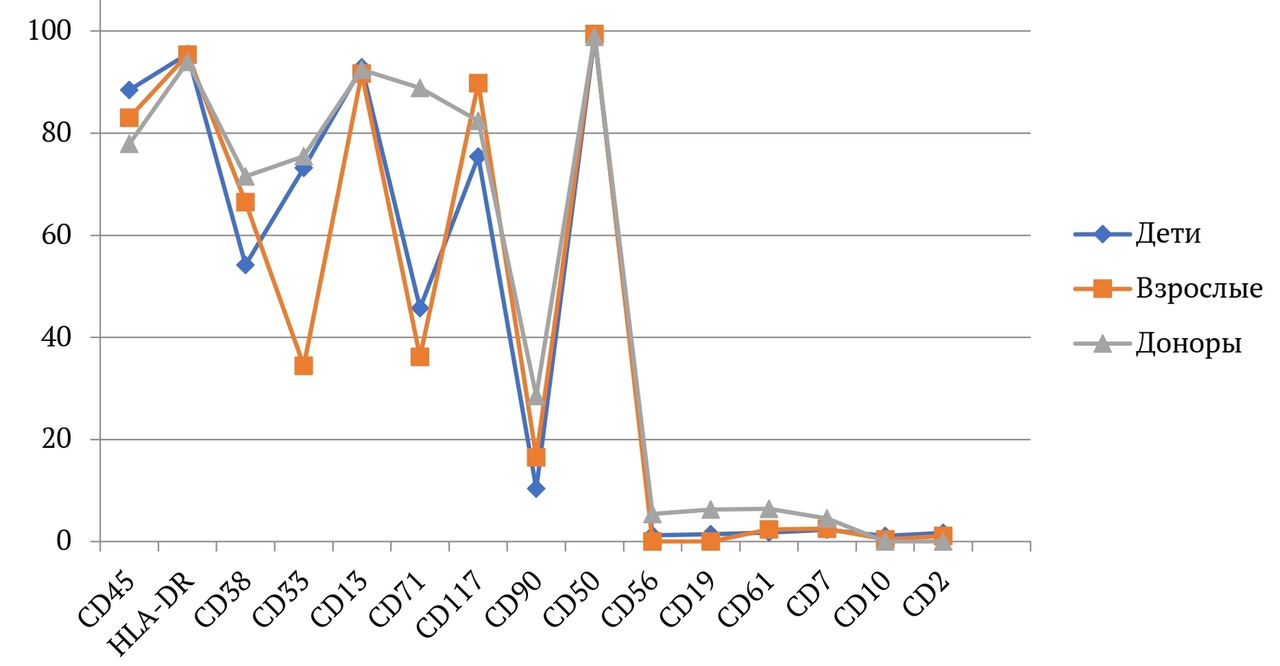
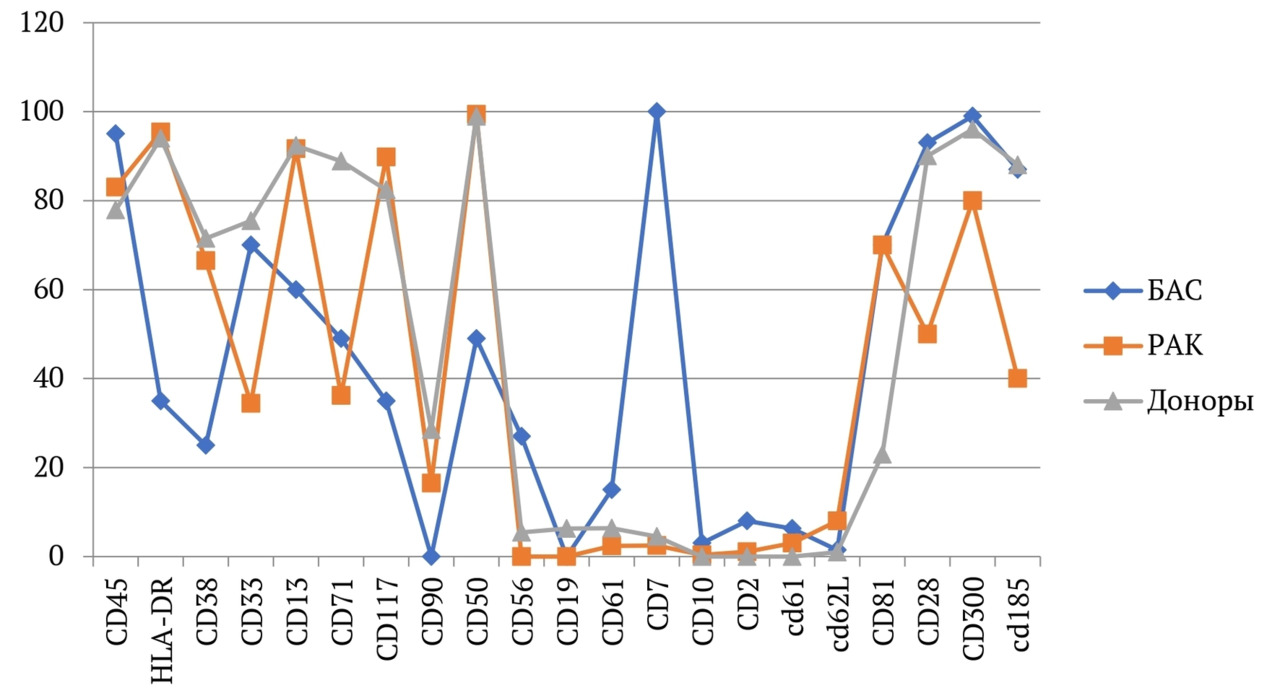
диаграмма), у 150 онкологических больных (красная диаграмма)
и 15 больных с боковым амиотрофическим склерозом (синяя диаграмма)
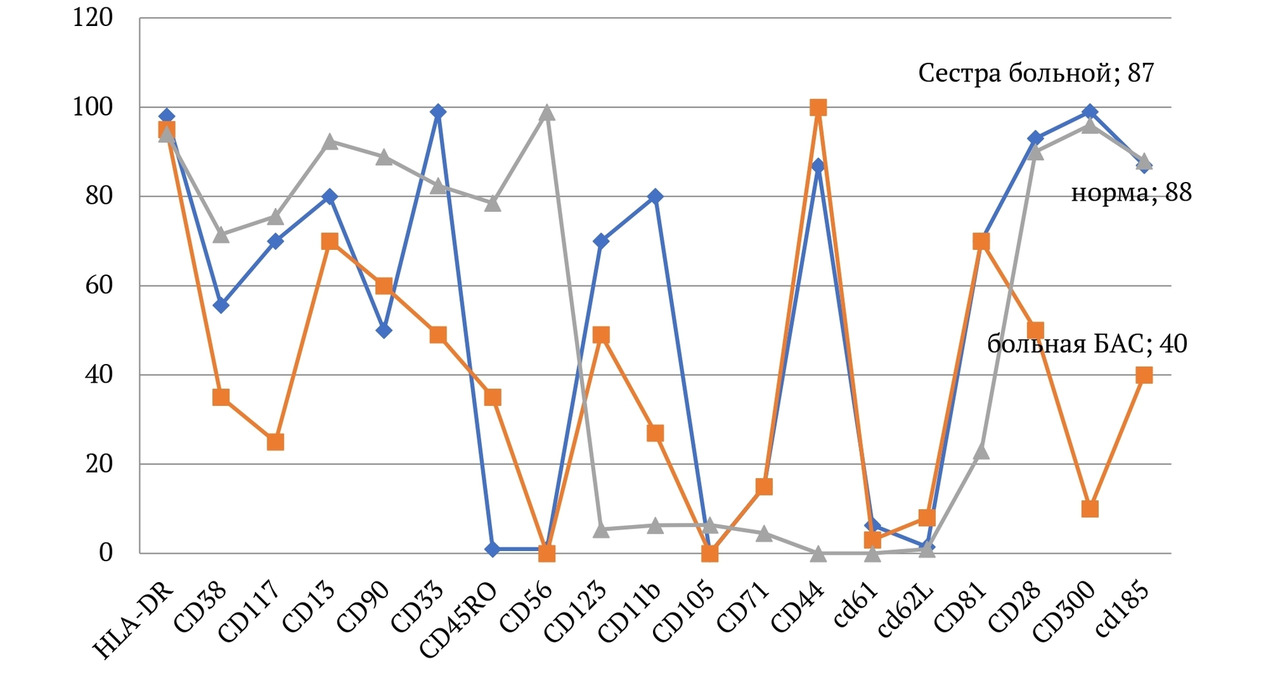
сестра, зеленая диаграмма — норма у здоровых доноров). Очевидны
отличия белкового профиля маркеров клеточной поверхности ГСК при
семейном боковом амиотрофическом склерозе (БАС)
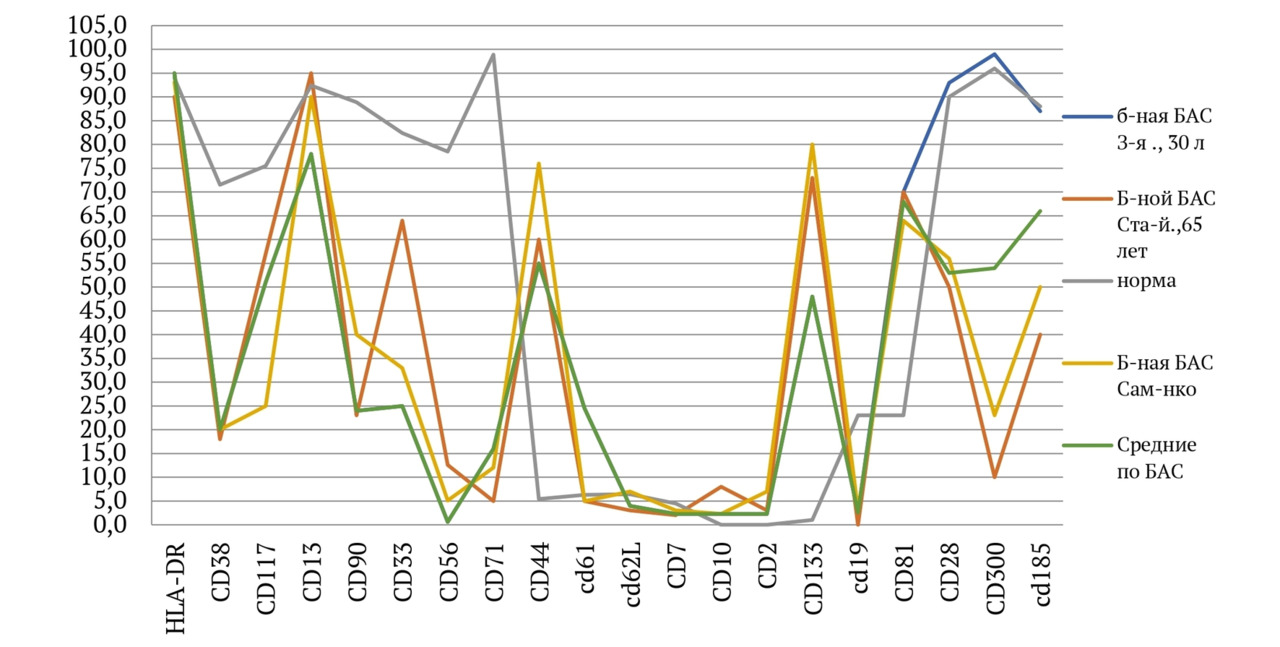
Белковый профиль маркеров клеточной поверхности ГСК при боковом
амиатрофическом склерозе (БАС) у отдельных больных, усредненный
профиль при БАС и в норме
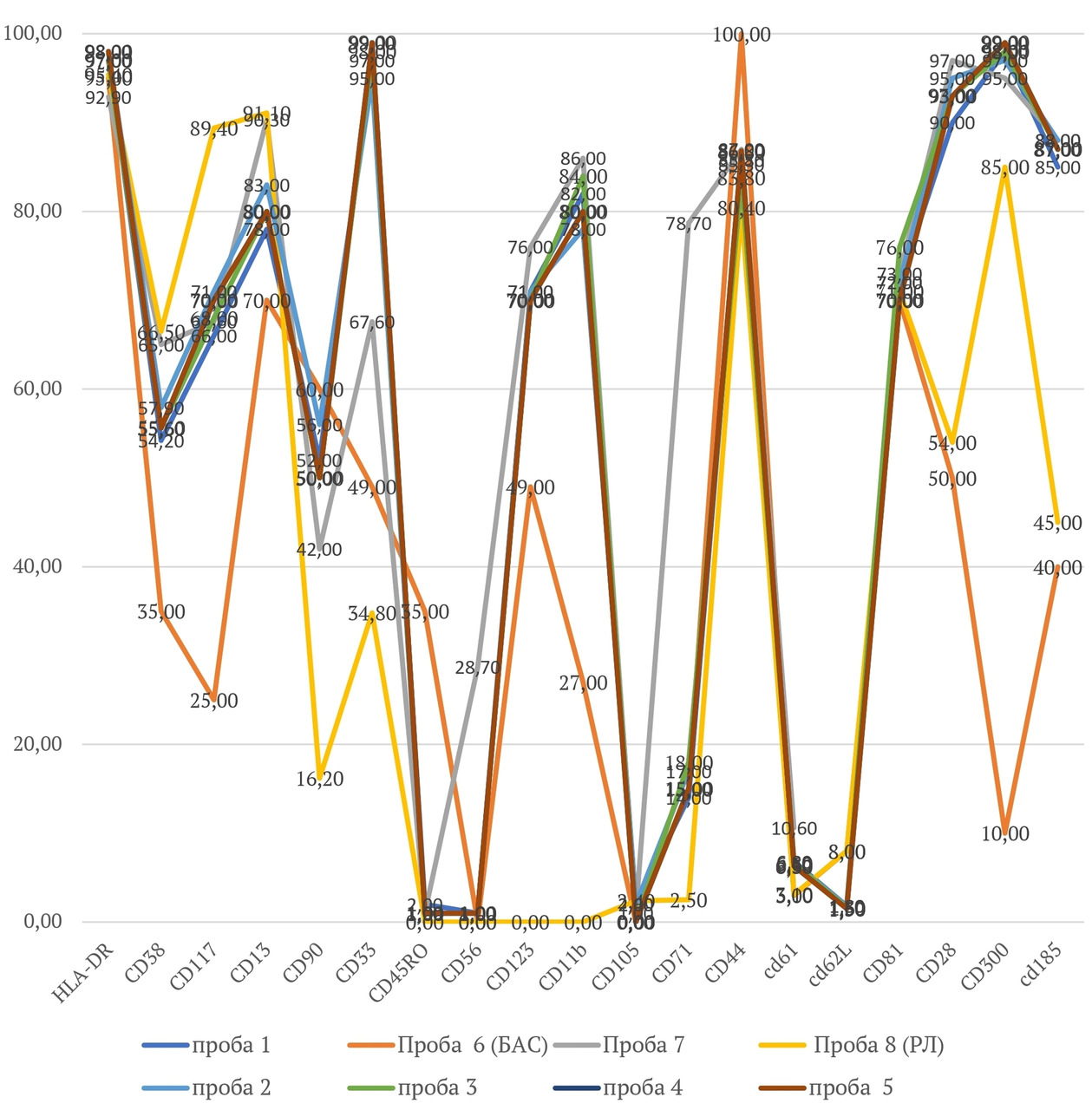
в норме (проба 1—3), при травме спинного мозга (проба 4—5, 7),
при БАС (проба 6) и при раке легких (проба 8)
Мы провели серию экспериментов с профилированием маркеров белков мембранной поверхности ГСК в случаях семейного БАС и увидели ту же закономерность, на которую и рассчитывали. У всех больных с семейной формой БАС были отмечены иммуноспецифические особенности антигенов поверхности ГСК, и отличия между больным с БАС и здоровыми родственниками, содержащими эту мутацию, были минимальны. По иммунофенотипическому профилю ГСК донора (здоровая сестра больной) и больного БАС (сама больная) получены расхождения по ряду антигенов. У донора в отличие от реципиента выявлено большее число CD117+ CD33+ CD28+ CD300+ CD11b+ CD123+ клеток-предшественников. Выявлено различие в количестве CD38+ предшественников, но у донора и реципиента экспрессия данного антигена слабая. Популяция ГСК, преобладающая у донора, характеризует моноцитарную направленность дифференцировки клеток-предшественников. Другими словами, мы можем на диаграмме иммунофенотипического профиля диагностировать манифестацию заболевания задолго до того, как появится манифестация болезни у больного с семейной формой БАС. При анализе иммунофенотипического профиля ГСК различных больных со спорадическими формами БАС получены отчетливые иммуноспецифические изменения протеомного профиля антигенов клеточной поверхности ГСК. У больных со спорадическими формами БАС, в отличие от нормы, выявлено большее число CD117+ CD33+ CD28+ CD300+ CD11b+ CD123+ клеток-предшественников. Выявлено различие в количестве CD38+ предшественников, но у донора и реципиента экспрессия данного антигена. На последней диаграмме (рисунок 5) представлены особенности профиля мембранных маркеров у пациентов с БП и БА в сравнении их с профилями других исследованных больных.
Для иллюстрации сказанного посмотрим на молекулярно-биологическую структуру мембранных белков гемопоэтических стволовых клеток некоторых из тех же самых пациентов с диагностированным CHIP в начале данной главы и сравним их с протеомным ландшафтом ГСК здоровых доноров.
Нами были проведены достаточно масштабные и статистически достоверные исследования БММП ГСК у большого количества онкологических больных с разными типами рака и ЗНО, что позволяет исключить ошибку малых чисел у этого контингента пациентов. Количество больных с БАС было небольшим, но результаты позволяют сделать верные и статистически обоснованные выводы. Сначала остановимся на обсуждении результатов исследования онкологических больных. Ранее мы показали в эксперименте, что у всех онкологических пациентов опухолевые стволовые клетки (ОСК) имеют изменения протеомной структуры на уровне белков клеточной мембраны, цитоплазматических и ядерных белков (Bryukhovetskiy A. S., Grivzova L. Yu., 2020). Однако протеомное картирование ГСК и профилирование белков кроветворных клеток путем проведения классической масс-спектрометрии ГСК для выявления всего спектра онкоспецифических изменений в этих клетках являются крайне дорогостоящими и длительными исследованиями и применяются только в научно-исследовательских работах (Брюховецкий А. С., 2014). В этой связи они практически не могут широко применяться к клинике и быть рабочими инструментами ранней диагностики рака. Нужна простая и достаточно надежная система маркеров ультраранней диагностики рака. Поэтому главной целью и сущностью предложенного нами способа ранней диагностики рака была разработка и создание простого, надежного и понятного способа диагностики рака на ранней стадии заболевания. Предложенный способ ранней диагностики ЗНО и НДБ был нами разработан и запатентован (Патент RU №2706 714 С1).
Бесплатный фрагмент закончился.
Купите книгу, чтобы продолжить чтение.